ひらめき PDメカニズム・レポートSerendipity PD mechanism report
パーキンソン病のメカニズム
パーキンソン病(PD)を患い脳、神経細胞、ドーパミン神経伝達物質、いろいろと疑問が次から次へと生まれてきます。ここでは、PDと症状(ジストニア)、ドーパミン量が上昇、下降した場合の症状、遺伝子、レヴィ小体、等のメカニズムを紹介したいと思います。
知見を増やすことで、ADL(日常生活動作)、QOL(快適な生活環境)の向上に。
(詳細は、下線部分をクリック)
パーキンソン病のメカニズム・関連
⑮ シヌクレノパチー
⑭ 神経変性疾患を防ぐ
⑬ GBA遺伝子とPDの関係性
⑫ PD進行に伴う脳部位の特定
⑪ PDにセルトラリンが有効!
⑩ PD 新たな知見「免疫細胞」
⑨ PD 進行に伴う出現症状の予測
⑧ 新たな知見「ジストニア」
⑦ PD 発症 Braak 仮説
⑥ ドーパミン トランスポーター
⑤ アミノ酸からの産生経路
④ 私見PDの出現症状
③ ド-パミン量 上昇・低下時の症状
② PD とジストニアのメカニズム
① 前頭葉とドーパミン量
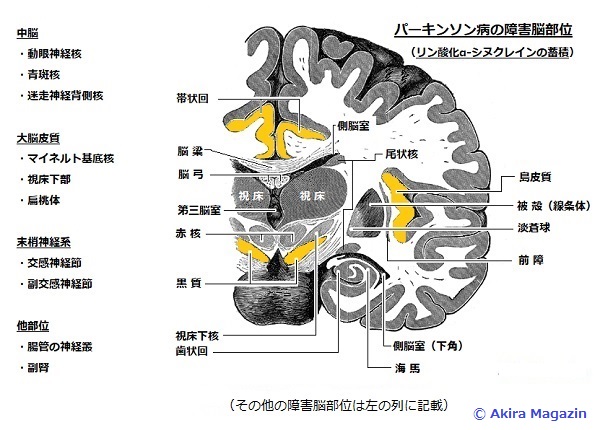
シヌクレイノパチーシヌクレイノパチー (α-シヌクレイン蛋白質の凝集で起こる疾患)神経細胞のシナプス前終末に豊富に存在するα-シヌクレイン(synuclein)蛋白質(詳細機能は不明)が過剰発現し異常構造物を形成する疾患をシヌクレイノパチーと提唱されている。この神経疾患には、 ・パーキンソン病 (parkinson's disease:PD) ・レヴィ小体認知症 (Lewy body disease :DLB) ・多系統萎縮症 (multiple system atropny:MSA) ①オリーブ橋小脳萎縮症 (olivopontocerebellar atrophy) ②線条体黒質変性症 (striatonigral degeneration) ③シャイ・ドラーガー症候群 (shy-drager syndrome) パーキンソン病 α-シヌクレイン(synuclein)蛋白質の凝集のレヴィ小体が形成される。 形成される脳部位は、 中脳では、黒質-緻密部、青斑核、動眼神経核、迷走神経背側核、脳幹諸核に広汎に形成される。 大脳では、マイネルト基底核、視床下部、偏桃体に形成される。 末梢神経系では、交感神経節、副交感神経節。 腸管の神経叢、副腎。
黒質ではドーパミン作動性神経細胞が変性、脱落することによりアストロサイト(グリオーシスにより中枢神経系に存在するグリア細胞の1つ)が形成され、神経メラニンを崩壊されることにより褐色から白っぽくなる。脱色は黒質、青斑核に生じる。
レヴィ小体認知症 大脳皮質、マイネルト基底核等にリン酸化したα-シヌクレインが蓄積する。 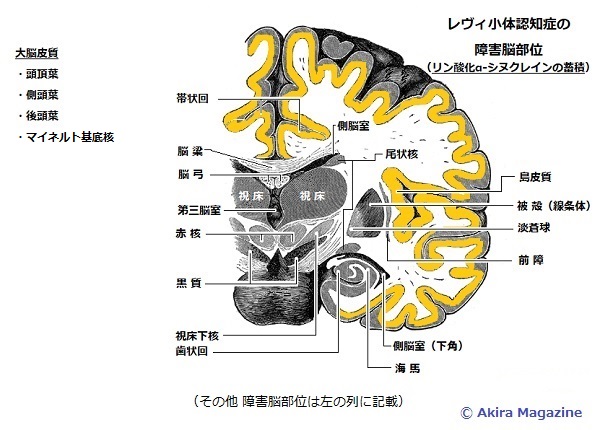
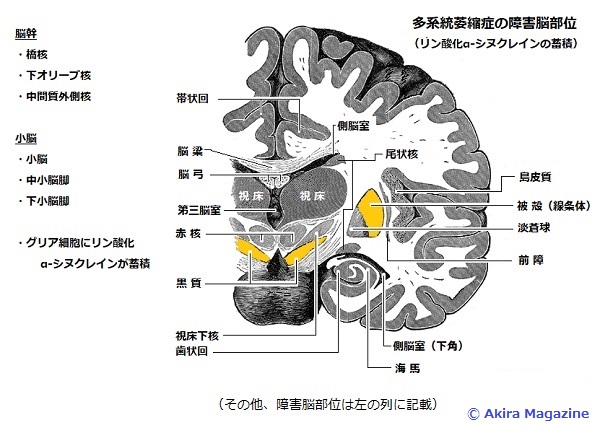
多系統萎縮症 α-シヌクレイン蛋白質は、主にグリア細胞質内封入体としてオリゴデンドロサイトに蓄積される。 ・オリーブ橋小脳萎縮症 橋では、橋核、横走線維が変性。入力系の中小脳脚、小脳白質、下小脳脚、
・線条体黒質変性症 線条体-被殻、尾状核が変性、脱落と線維性アストロサイトの増生。 黒質-緻密部が脱落。
・シャイ・ドラーガー症候群 脳幹、脊髄(自律神経系)の諸核が変性。 胸髄の中間質外側核、迷走神経背側核、青斑核など自律神経系の核が変性。
 |
| 用語解説 シナプス前終末: 神経細胞の軸索終末端とも言われ役割は、神経伝達物質を放出する部分。 神経伝達物質の放出は、神経細胞の電気信号である活動電位が神経軸索終末端に到達すると終末端から小胞(袋)に包まれた神経伝達物質をシナプス間隙(終末端と受容体細胞(樹状突起)との間)に放出。 小胞(袋)は軸索終末端に取り込まれ再利用される。この取り込まれる(融合)をエンドサイトーシスと呼ばれている。 α-シヌクレイン(alpha-synuclein)蛋白質: SNCA遺伝子によりエンコード(一定の規則に従って、目的に応じた符号に変換すること)された140アミノ酸残基からなる蛋白質で、神経細胞の軸索終末端に多く局在している。 多く局在している脳部位は、(後日記載) 過剰なα-シヌクレイン蛋白質がエンドサイトーシスの機構を阻害されると示唆されています。 エンドサイトーシス機構の阻害とは、過剰なα-シヌクレイン蛋白質が微小管の結合(重合)を促進 → 過剰に形成された微小管が小胞エンドサイトーシスを阻害 → エンドサイトーシスの再利用が遅れ → 小胞の枯渇して神経伝達が低下することにより支障、疾患を発症。 また、 過剰なα-シヌクレイン蛋白質は、神経細胞の変性、脱落(細胞死滅)に結び付きます。 レヴィ小体: α-シヌクレイン蛋白質のリン酸化された凝集で、神経細胞に出現した円形状の構造物(封入体)。 ドーパミン、ノルアドレナリン、セロトニン、アセチルコリンを分泌する神経細胞に好発する。 黒質-緻密部: ドーパミン作動性神経細胞で、ドーパミンを分泌する。線条体のD1受容体、D2受容体に投射して興奮を抑制。 また、淡蒼球、黒質-網様部、視床下核にも投射する。 島皮質: 身体表象と主観的な感情の体験における役割、意識的な感情を生み出す情動の体験に関連し、直感的な状態の役割を担っており前部と後部では細胞構造が異なる。 前部は、嗅覚、味覚、内臓自律系、及び辺縁系の機能により強く関わる。 視床の内側腹側核基部 から直接の投射を受け、扁桃体の中心核からの強い入力を受ける。また、扁桃体への投射します。 後部は、聴覚、体性感覚、骨格運動とより強く関わっている。二次感覚野 と相互に接続しており、脊髄視床路によって活動が引き起こされた視床の下後腹側核からの入力を受け運動における目的のための行動の知覚と関係していると示唆されています。また、視床の内側腹側核の後部からの入力を受けることも示されています。 帯状回: 大脳辺縁系の各部位を結びつける役割を果たしており、感情の形成と処理、学習と記憶に関わりを持つ部位。 また、呼吸器系の調整、感情による記憶にも関わりを持つています。 青斑核: 脳幹に位置しノルアドレナリン作動性神経細胞を含む神経核で、大脳皮質、視床、海馬、小脳、脊髄に投射している。覚醒レベル、注意、情動反応に関与している。 体の各部からの感覚刺激(入力)は脳幹を経由(上行)して大脳皮質に向かう大切な中継点。 感覚刺激の一部は、脳幹網様体 → 視床 → 大脳皮質(上行性網様賦活系)がある。 姿勢反射は青斑核が関与しているとも示唆されている(青斑核 → 脊髄に投射して四肢の筋肉活動に影響)。 慢性のストレスにより青斑核が縮小、変性が起こり うつ病が起こる可能性も示唆されている。 また、新しい刺激により強く反射し、同じ刺激が繰り返されることで刺激に慣れ反応が減弱する事も青斑核が関与しているとも示唆されている。 動眼神経核: 眼球運動に関わり、瞳孔収縮、水晶体の厚みも調節、瞼をあける運動を行う。 眼球の向きを動かす(上斜筋)は滑車神経が担い、外側直筋を担う外転神経がある。 迷走神経背側核: 首から腹までの内臓の運動神経と副交感性の知覚神経が迷走神経が担う。 心拍数の調整、胃腸の運動、発汗や言語を音声として発する発話、頚動脈小体における血中ガス分圧の感知、外耳道感覚、皮膚感覚、深部感覚、内臓感覚(体性感覚)を担っている。 脳幹: 中枢神経系を構成する器官集合体で、中脳、腹側被蓋野、赤核、橋、青斑核、延髄と間脳を合わせて脳幹と呼ばれ、生存の上で欠かせない自律機能を直接制御している重要な部位であるり睡眠・覚醒レベルの調整、姿勢運動制御も行っています。脳幹は多種多様な神経核から構成されており、その機能も当然ながら多様であり、この小さな部分に多数の生命維持機能を含んでいます。間脳は、脳幹の中で第三脳室を囲む脳部位を言います。嗅覚を省き感覚伝導路として大脳皮質に多くの線維(神経細胞)で結ばれています。自律神経の働きを調節、意識・神経活動の中枢をなしています。 マイネルト基底核: 前脳基底部にある神経細胞群で大脳皮質・扁桃体・視床に神経線維が繋がっておりアセチルコリン産生、投射。 視床下部: 内臓の働きや内分泌の働きを制御し、生命現象をつかさどる自律神経系の交感神経・副交感神経機能および内分泌機能を全体として総合的に調整しています。 体温調節、抗利尿ホルモン、血圧、心拍数、摂食行動や飲水行動、性行動、睡眠、子宮筋収縮、乳腺分泌などの本能行動、怒りや不安などの情動行動(大脳皮質・辺縁系皮質)の調節、自律神経系をコントロールする中枢の役割の他、内分泌(下垂体ホルモンの調節)の中枢も担っています。 (呼吸運動や血管運動などの自律機能は、中脳・橋・延髄で調節される) 扁桃体: 情動反応の処理と短期的記憶において主要な役割を持ち、情動・感情の処理(好悪、快不快を起こす)、直観力、恐怖、記憶形成、痛み、ストレス反応、特に不安や緊張、恐怖反応において重要な役割も担っています。 恐怖感、不安、悲しみ、喜び、直観力、痛み、記憶、価値判断、情動の処理、交感神経に関与。 交感神経節: ノルアドレナリン作動性の場合には交感神経節、アセチルコリン作動性の場合には副交感神経節と呼ばれる。 副交感神経節: アセチルコリン作動性の場合には副交感神経節、ノルアドレナリン作動性の場合には交感神経節と呼ばれる。 腸管の神経叢: 腸管神経系は食道から肛門まで広がる神経の網目(神経叢)によって構成されて消化管運動(消化管平滑筋により)を担っている。 食道 → 胃 → 十二指腸(長さ約25cm) → 空腸(長さは約2.4m) → 回腸(長さは約3.6m) → 大腸(長さは約1.6mで盲腸、結腸、直腸と大別される) → 肛門そして排泄。 (十二指腸~回腸末端までの内分泌物移動時間は1分間に1~4cm) 腸管神経叢が欠損している場合は、大腸運動がうまく機能しなく便秘症状を訴える事が多い。 副腎: ステロイドを分泌する内分泌臓器。 中胚葉から発生した副腎皮質と、外胚葉から発生した副腎髄質に分けられる。 副腎皮質からは、主としてハイドロコーチゾン (糖質ホルモン) 、アルドステロン (電解質ホルモン)、 副腎性男性ホルモンが分泌される。 副腎髄質からはアドレナリン、ノルアドレナリンなどのカテコールアミンが分泌される。 頭頂葉: 五感といわれる、視覚、聴覚、嗅覚、味覚、皮膚感覚(触覚、痛覚、温覚、冷覚)に加え、運動感覚、平衡感覚、内部感覚から感覚情報の統合を行っており、空間感覚と指示の決定を担っている。 側頭葉: 聴覚認知、言語の受容、視覚的な記憶、言語的な記憶、および感情に不可欠である。 右側頭葉に病変を有する患者は、一般的に非言語的聴覚刺激(例、音楽)を解釈できなくなる。 左側頭葉に病変が生じると、言語の認識、記憶、および構成が著しく損なわれる。 後頭葉: 中枢神経系の網膜から直接情報を受け取り、形態視情報(形状、色)、空間視情報(運動と三次元状態)に分け認知される。また、視覚情報だけでなく聴覚(音)、触覚(体性感覚野)、臭覚情報によりイメージ(映像化)情報を視覚野で作り出すと推測されています。 線条体(被殻): 運動機能への関与(被殻が担う)、意思決定(依存や快楽)などその他の神経過程にも関わると推測されています。線条体が機能低下により対人恐怖症、社会恐怖症に成るケースが多いと言われています。 (例:人前に出ると震えたり、手の平に汗をかいたり、顔の筋肉が硬直したりする) 橋核: 顔の筋肉、唾液腺、味覚、聴覚、眼球運動を動かす神経核 。 横走線維:後日記載。 中小脳脚: 小脳と橋を連絡する神経路の束から成る。 小脳白質: 小脳で神経線維(軸索突起)が集積し走行している領域。 下小脳脚: 下小脳脚は脊髄、延髄からの伝導路。 下オリーブ核: 延髄の錐体の外側にあるオリーブを構成する神経核で、小脳に向かう出力線維が通過する。 尾状核: 学習と記憶のフィードバック処理に強く関わっている。 主に腹側被蓋野 、 黒質-緻密部からドーパミン神経を受けている。 また、様々な関連する大脳皮質からも入力を受けている。 中間質外側核: 交感神経節前線維の神経細胞体の集合体。 小脳: 主要な機能は知覚と運動機能の統合で、平衡・筋緊張・随意筋運動の調節などを司る。 中小脳脚: 中小脳脚は、「大脳皮質の感覚野・運動野 → 橋 → 小脳」を結ぶ壮大な経路の一部を成す。 下小脳脚: 平衡や姿勢の保持など、運動前庭機能を伴う固有感覚入力の統合に関与する。 グリア細胞: 神経系を構成する神経細胞ではない細胞の総称で、アストロサイト、オリゴデンドロサイトおよびミクログリアの三種に分類される。 役割は ・神経細胞の位置の固定(他の体細胞にとっての結合組織に相当)。 ・神経栄養因子の合成と分泌。 ・髄鞘(ミエリン)の構成要素となる。 ・過剰に放出されたカリウムなどのイオンの再取り込み。 ・神経伝達物質を細胞内に回収することで伝達時間を限定させる。 ・血管内皮とともに血液脳関門を形成し、フィルタの役割を果たす。 |
神経変性疾患を防ぐ神経変性疾患を防ぐ細胞同士の働きを!!国立精神・神経医療研究センター神経研究所疾病研究第四部の永井義隆室長、武内敏秀研究員(京都大学)らの研究グループは、細胞同士が防御因子「分子シャペロン」をやり取りすることで、アルツハイマー病、パーキンソン病、ポリグルタミン病などの神経変性疾患で起きる異常タンパク質の凝集を防ぐという、生体内の新しい防御機構が明らかになったと発表した。本研究は科学技術振興機構(JST)の戦略的創造研究推進事業の一端として行なわれている。 分子シャペロンがエクソソームと呼ばれる小胞に包まれた状態で細胞から分泌された後、周辺細胞に取り込まれることでタンパク質の凝集を抑える働きを発見。この仕組みは、ポリグルタミン病のショウジョウバエモデルを用いて実験され、筋肉や脂肪などの末梢細胞からの分子シャペロンが、神経細胞の変性を防ぐという結果により確認された。 |
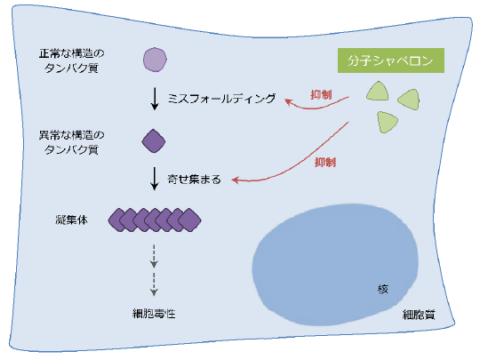 |
GBAGBA遺伝子とPDの関係性グルコセレブロシダ-ゼ(GBA)とは?? グルコセレブロシダーゼ (Glucocerebrosidase:GBA)とは、細胞内リソソームに局在する加水分解酵素。 生体糖脂質であるグルコセレブロシドの糖と脂質の脱水縮合部位を分解する酵素。 (グルコセレブロシダーゼはグルコセレブロシドからグルコースを切り離す酵素) グルコセレブロシダーゼの欠落は、神経や肝臓、脾臓や骨などの組織内で蓄積が認められゴーシェ病の要因。 GBA・パーキンソニズム 変異したGBAがシヌクレインパーチ(孤発性パーキンソン病、レヴィ小体認知症等)の危険因子として作用する事が、研究者により示唆されています。 パーキンソニズムとジストニアを中心とした神経障害の原因遺伝子は、ATP13A2・PLA2G6と示唆されています。 ATP13A2蛋白質は、リソソーム内のpHの維持を行い、脂質代謝において脂質のリサイクルに関与している。 リソソームは細胞内の小器官、なかでもミトコンドリアに鉄を供給する役割をもっており、リソソームに障害があるとミトコンドリアの鉄代謝に影響を及ぼすと考えられる。 細胞内の糖脂質を分解するライソゾーム酵素、GBAの欠乏(活性低下)によりパーキンソニズムを合併しやすく鉄の沈着もみられている。 PLA2G6蛋白質は、ミトコンドリア内膜のリン脂質(phospholipid)代謝に関与し、脂質二重膜の維持を行っていると考えられている。 PD発症とGBAの関係性 弧発性のパーキンソン病(PD)やレヴィ小体型認知症(DLB)においてゴーシェ病の原因遺伝子GBAの変異が有意に高いこと、変異型GBAが弧発性シヌクレイノパチーの危険因子として作用する。 (PDやDLBは、αシヌクレイン蛋白質の異常構造化が糖脂質の蓄積で引き起こされると報告があり、糖脂質分解酵素の一つであるグルコセレブロシダーゼ(GBA)遺伝子が変異している場合、認知症の発症確率は通常の約8倍、パーキンソン病では約5倍と報告されている) ゴーシェ病はGBA遺伝子の変異が原因で、GBA活性が低下し、細胞内に糖脂質が大量に蓄積する常染色体 劣性遺伝の代謝異常症である。臨床的に肝脾腫、貧血、易骨折性などを主な特徴とし、さらに、けいれん、斜視、開口困難などの神経障害を呈する。現時点において、ゴーシェ病の原因となるGBAの変異がどのようにしてシヌクレイノパチーを促進するかは不明である。しかしながら、GBA変異の対立遺伝子からなる事(ヘテロ接合性)により、孤発性PDに罹患しやすくなる。 GBAの変異をともなうPD剖検脳のレヴィ小体においてGBAの免疫原性が報告され、変異型GBAは凝集能が高く、このことが原因でα-シヌクレインの凝集を促進し、神経変性を促進するという可能性が考えられている。 近年ゲノム解析により、GBAの遺伝子変異が弧発性シヌクレイノパチーの危険因子として作用することが確定された。GBAがアミノ酸変異により構造変化を起こして凝集しやすくなる結果、α-シヌクレインの凝集を誘発しレヴィ小体に至り神経変性に成ると考えられる。 今後グルコセレブロシダーゼ(GBA)遺伝子の酵素活性を高めたり、糖脂質グルコシルセラミドの蓄積を抑制することが出来れば治癒が可能と考えられる。 GBA遺伝子異変を保有のPD患者では 認知機能障害が認められ、嗅索、脳梁、両側内包前脚の拡散異方性比率が低下、さらに右前外包、左帯状束、傍海馬神経路、上縦束の頭頂部、後頭葉白質にも低下が見られ、大部分の白質経路で拡散異方性比率が低下している。また、言語流暢性スコアと白質異常との間に相関性が認められた。 大脳半球間神経路、前頭皮質間神経路、傍海馬神経路が関与する白質異常の分散型パターンが認められる。 これらの白質病変は、認知機能障害、PDの臨床症状に影響を及ぼす可能性が有ると指摘されている。 用語解説 ゴーシェ病: ライソゾーム病、先天性代謝異常症、常染色体劣性遺伝に分類される。 ライソゾーム病(リソソーム病、リソゾーム病、リソソーム蓄積症): 細胞内にある小器官の一つであるライソゾームに関連した酵素が欠損しているために、分解されるべき物質が老廃物として体内に蓄積。 参考:・Sidransky E, N Engl J Med. 2009, Mitsui J, Arch Neurol. 2009 ・Sidransky E, N Engl J Med. 2009 ・Goker-Allan et al. Acta Neuropathol. 2010 ・Sidransky E, N Engl J Med. 2009, Mitsui J, Arch Neurol. 2009 ・Movement Disorders.Vo l28,No.6 2013,pp.772-778 |
 グルコセレブロシダーゼ イメージ 出典画像:Wikipedia |
PD進行に伴う脳部位の特定PD進行に伴う脳部位の特定東北大学は2014年10月31日、パーキンソン病の悪化に関連する因子(予後予測因子)の発見に成功したと発表。 東北大学大学院医学系研究科高次機能障害学の森 悦朗 教授、同大学病院高次機能障害科の西尾 慶之 講師、同 馬場 徹 助教、県南中核病院研修医の庄司 裕美子 医師らの研究による。 PDは、長期の経過中に約8割の患者が認知症になることが知られている。しかし、現時点では病初期の段階で後の認知症の発症を予測することはできていなかった。 東北大学の研究チームは、53名の認知症のないPD患者を対象に、3年の間隔を開けて2回の検査を施行し、初回の検査成績とその後3年間の検査成績の変化との関係について調査を実施。患者を以下の5つのグループに分け、運動機能、認知機能(記憶、視知覚、遂行機能)、局所ブドウ糖脳代謝の結果を比較。 ①初年度に認知障害がなく、3 年後にも認知障害のないグループ。 ②初年度に認知障害がなく、3 年後に記憶障害だけをきたしたグループ。 ③初年度に認知障害がなく、3 年後に記憶およびその他の認知障害をきたしたグループ。 ④初年度に記憶障害のみを認めたグループ。 ⑤初年度に記憶障害およびその他の認知障害を認めたグループ。 結果、初年度に認知障害を認めなかったグループ(①~③)のうち、①、②のグループの臨床症状、脳代謝パターンが類似していた一方で、グループ③は①、②のグループに比べて初回検査時の側頭・頭頂葉の代謝が強く低下していた。また、グループ③は初回評価時に視知覚障害が認められ、その後3年間の認知機能および運動機能の悪化が重度だった。初年度に認知障害を認めた④、⑤のグループの比較においても同様の差が認められた。 以上の結果から、記憶および視知覚に障害を認めるPD患者は、認知機能はもちろん運動障害も急速に進行する可能性が示唆された。 記憶および視知覚に障害を認めるPD患者においては、これまで考えられていたよりも早い段階で大脳新皮質(側頭・頭頂・後頭葉)に神経変性が起こり、これが病状を急速に悪化させる要因になっていると考えられる。 PDの悪化要因が明らかになった事で、予後予測や認知機能障害に対する早期介入に繋がることが期待される。 |
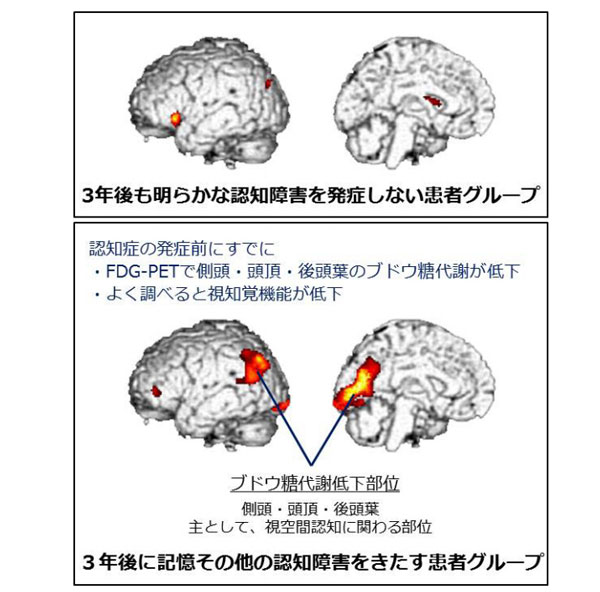 認知障害の発症と脳のブドウ糖代謝低下 (PDの悪化に関連する予後予測因子の発見) |
PDに「セルトラリン」が進行を抑制パーキンソン病に「セルトラリン」が進行を抑制!!抗うつ剤に使用されている選択的セロトニン再取り込み阻害薬 (SSRI) がパーキンソン病の進行を抑制する可能性が有ると東北大大学院 医学系研究科 神経内科学分野の長谷川隆文助教、同・今野昌俊医師、同・武田篤准教授らの研究グループにより発表された。研究の詳細内容は、米国科学雑誌「Molecular Neurodegeneration」電子版に掲載された。 パーキンソン病や多系統萎縮症では、脳内の神経・「グリア細胞」内に毒性を持つ α-シヌクイレンと呼ばれる異常なタンパク質凝集物が蓄積し、「レヴィ小体」あるいは「グリア細胞内封入体」といった細胞内凝集体が形成され、年月と共に神経変性が進行して行く。このα-シヌクイレンは細胞外に放出された後、隣接する細胞へ再び取り込まれ周囲に病変を伝播させることが判ってきた。 研究グループは細胞内へ物質を取り込む際に重要な役割を持つタンパク質「ダイナミン」に着目。遺伝子操作によりダイナミン機能を抑えることで神経細胞へのα-シヌクイレン取り込みが抑えられることを確認した。 強力なダイナミン阻害作用を有するセルトラリンが、神経・グリア細胞へのα-シヌクイレン取り込みを低減させ、細胞間におけるα-シヌクイレン伝播を抑制することを培養細胞モデルにて証明したのである。 パーキンソン病や多系統萎縮症の脳細胞の喪失は数年以上にわたりゆっくりと進んで行く。よって、早期に病気を発見しセルトラリンの服用を開始することにより、周辺への病変拡大が抑えられ症状進行を遅らせることが期待される。 |
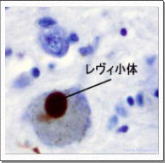 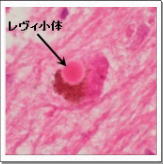 α-シヌクレインが凝集したレヴィ小体 |
PDの新たな知見PDの新たな知見( 免疫細胞 )immune cell2014年4月19日 コロンビア大学のDavid Sulzer博士らによって、パーキンソン病が自己免疫疾患の1種である可能性が示された。動物の細胞はウイルスなどに感染すると細胞膜上にMAC抗原を生成し、免疫細胞の1つT細胞の攻撃ターゲットとなるが、神経細胞にはこのような機能はないと考えられていた。 Sulzer博士らは、パーキンソン病に侵されるなど特定の条件下では、神経細胞がMHC抗原を生成することを発見。この実験は、胚性幹細胞(ES細胞)から作成された神経細胞を利用して行われたため、実際のヒトの体内で同様の現象が起こっているのかは確認されていないが、パーキンソン病は自己免疫疾患の1種である可能性があると示唆しました。 元記事: Is Parkinson's an autoimmune disease. Nature Communications,2014 免疫細胞とは 病原体と戦い体を守ってくれる細胞で、免疫細胞の働きには年齢によって大きな違いがあります。免疫細胞の数は大人で約2兆個で体全体の細胞60兆個の細胞を守っています。免疫細胞は脊髄の中にある骨髄の中のニッチと言う場所で1日1,000億個以上作られます。その一つがT細胞(リンパ球の一種、前駆細胞が胸腺での選択を経て分化成熟した細胞)で侵入した異物が敵かどうか判断し指示をだす細胞です。 免疫細胞は血液に乗って全身に行きわたります。センサー役の樹状細胞が異物を発見するとT細胞へ運び攻撃対象かを判断して攻撃対象であればサイトカインと言う物質を放出してマクロファージ( 白血球の一種で、死んだ細胞やその破片、体内に生じた変性物質、癌細胞や侵入した細菌などの異物を捕食して消化する食細胞 )が働き健康が維持されます。また、 T細胞が何らかの原因で誤作動が起った場合、正常な自分の細胞も攻撃して老化の要因、脳出血、心筋梗塞、動脈硬化、慢性肝炎、骨粗しょう症、慢性腎臓病、高血圧症、糖尿病も免疫細胞が深く関わっているとの指摘もあります。
免疫細胞の活性化 衰えた免疫細胞の活性化するには、1日5分の運動で筋肉から分泌された物質が免疫細胞を活性化させると言うイギリスのバーミンガム大学の研究発表があります。 用語解説 MHC抗原: 主要組織適合遺伝子複合体(しゅようそしきてきごういでんしふくごうたい)major histocompatibility complexと呼ばれる糖蛋白質。 細胞に感染した細菌、ウイルス、癌細胞、抗原提示細胞に貪食処理されたペプチドなどがMHC抗原に結合して細胞表面に提示され、リンパ球のT細胞に攻撃対象と認識され、細菌、ウイルスや癌、異物などを攻撃排除する。 |
||||||||||||||||||||||||||||||||||||||||||||
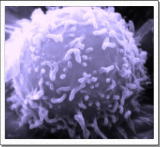 T細胞 出典画像:Wikipedia Commons |
||||||||||||||||||||||||||||||||||||||||||||
PD進行に伴う出現症状の予測PD進行に伴う出現症状の予測(平成26年02月20日Report)はじめに レヴィ小体蓄積の脳部位をベースに 嗅神経系・腸管系よりレヴィ小体の進行が同時に進行した場合の出現症状を予測をまとめると、うつ症状が出現 → 軽度な認知症 → いびき、寝言がハッキリ聞き取れる → 顔の表情が硬くなる → 幻視・ふらつきがある → 幻聴、音に敏感になる → 手足の震え、筋肉の硬直、寡動、無動、前屈みの姿勢(パーキンソン病の診断)→ 認知、記憶障害・幻聴 → 論理的思考・創造性・意思決定が困難になる。 レヴィ小体の蓄積を抑える パーキンソン病の診断がなされる数年前からレヴィー小体の発現があり徐々に進行していく病と考えられる。 レヴィ小体の発現を阻害、発現率を把握できれば発病を抑制できると考えられる。早期発見、レヴィ小体の検査方法の確立が望まれる。また、 レヴィ小体は、リン酸化されたα-シヌクレインの凝集と判明しているので凝集のメカニズム解明が急務。 α-シヌクレインの凝集を抑制する物質クミンアルデヒド(ユーカリ、ミルラ、カシア、クミンなどに含まれる)、ピロロキノリンキノン(納豆、パセリ、豆腐、緑茶、ピーマン、パパイヤなどに含まれる)、フラボノイド(、ワイン、ココア、紅茶含まれる)、アントシアニン ( ブドウの実皮やムラサキイモ、ブルーベリーなど含まれる)酸化還元補酵素もα-シヌクレインの凝集や蓄積が抑えられると発表されているので数多い検証が待たれる。 その他、ASC細胞(皮下脂肪に含まれる細胞)も神経細胞の修復に活用の可能性が見出されているので検証が期待できそうである。 レヴィ小体の蓄積の進展 ① 嗅神経系より進行 うつ症状 → 認知症 → 味覚、臭覚が鈍感 → 体温調節、下垂体ホルモンの調節、摂食行動や飲水行動、性行動 、睡眠などの本能行動、怒りや不安などの情動行動に関与した支障。 ② 腸管系より進行 内臓(呼吸器系、消化器系、心臓、血管、結腸)の副交感神経系 → うつ病、パニック障害、REM睡眠症→ 上顎神経、下顎神経、顔面神経、表情筋の運動で、涙腺、唾液腺の分泌、味覚などに支障 → 平衡の感覚→ 中脳による聴覚 → 運動神経系(パーキンソン病発症) → 側頭葉による認知、聴覚 → 痛みの体験や喜怒哀楽や不快感、恐怖などの基礎的な感情 → 思考や創造性、情動・動機づけ、意思決定に関与した支障。 Braak仮説について 2003年 臨床病理的研究で発表した、Braak(ドイツの病理学者)のBraak仮説では、抗α-シヌクレイン抗体を用いて高齢者の中枢神経系におけるレヴュ小体(Lewy小体)の分布を詳細に検討し、Lewy小体はまず嗅球に出現、迷走神経背側核(延髄)、視床と、その後、下部脳幹(橋)、中脳黒質、扁桃体へ上行進展して運動症状を発現させる。 さらに前脳基底部(basal forebrain)、側頭葉皮質、大脳新皮質へと上行拡大して、精神症状など様々な非運動症状に関係すると考えられている。また、Zaccai博士の報告によると扁桃体に優位にLewy小体が分布しているとの報告もある。 レヴィ小体がパーキンソン病を起こす Braak仮説では、嗅粘膜と腸管の上皮から病原体(neurotropic pathgen)が侵入して、Lewy小体を形成。 病原体の侵入経路(神経核・脳部位) ① 嗅粘膜 → 前嗅神経核 → 扁桃体→海馬 → 視床下部(運動神経系核、大脳皮質嗅覚野(眼窩前頭皮質) ② 腸管粘膜 → 粘膜下神経叢 → 副交感神経節前線維 → 迷走神経背側運動核 → 青斑核・橋 → 中脳 → 黒質 → 側頭葉 → 島皮質 → 帯状回 → 前頭前野。 ① 臭覚系より病原体の侵入経路による起因する脳部位・神経核の概略説明。 ・臭覚路: 臭いは嗅覚線維 → 嗅球 → 終止部位(前嗅核、嗅結節、扁桃核、梨状葉皮質、視床下部) ・扁桃体: 扁桃核 → 海馬 → 脳弓 → 視床下部の乳頭体、中隔核。快・不快、平気・恐怖、接近・回避・攻撃の判断などを司る。この部位を破壊されたサルは、普段は怖がって逃げる犬を近づけても逃げなくなります。また、猫や鼠は、嫌な臭いの物を近づけられても避けようとしなくなります。 ・海馬: 過去の経験記憶、学習によっても危険を回避しますが、海馬はこの学習に関して大きく作用。海馬には「大人になっても新しく神経細胞が作れる・長期増強が可能」という特異な性質がある。 ・視床下部:視床下部 → 脳幹 → 運動神経起始核。視床下部 → 大脳皮質嗅覚野(眼窩前頭皮質)に伝わり臭いを認識する。視床下部が嗅覚、味覚、情緒の統合センターであると同時に、自律神経系、内分泌系の中枢部位としての役割を果たしています。 ② 腸管系より病原体の侵入経路による起因する脳部位・神経核の概略説明。 ・迷走神経: 迷走神経は主として胸腹部の内臓を支配する副交感性の神経で知覚性で、副交感部は呼吸器系、消化器系、心臓、血管などの内臓を下行結腸のレベルまで支配する。 1)外耳道皮膚の温痛感覚の情報を伝える。 2)喉頭・喉・気管・食道・腹部内臓の感覚の情報を伝える。 3)咽頭下端からの味覚、咽頭下半・喉頭・諸臓器からの一般感覚を伝える。大脳皮質、三叉神経、舌咽神経、孤束核、迷走神経背側核などから出力を受ける。燕下、せき、嘔吐などの反射にとって重要。 ・青斑核: ノルアドレナリン(神経伝達物質や副腎から血液に放出されるホルモン)作動性神経細胞を多数含む神経核。ストレスとパニックに対する生理学的反応に関与し、脊髄、脳幹、小脳、視床下部、視床中継核、扁桃体、終脳、大脳皮質などに出力している。 ノルエピネフリンは多くの脳部位を興奮させ、ニューロンを活性化させる。うつ病、パニック障害、REM睡眠症に関与する部位で、アルツハイマー病ではノルアドレナリン神経細胞の最大70%が失われている。 ・橋: 三叉神経、外転神経、顔面神経、聴神経といった多くの脳神経核が存在。 ・三叉神経: 眼神経、上顎神経、下顎神経の三神経。体性運動性と知覚性の混合神経。 ・外転神経: 眼球を外側を見るように動く神経。 ・顔面神経: 顔面に分布し主として表情筋の運動を司る神経、涙腺、唾液腺の分泌、味覚などに関係。 ・聴神経: 平衡の感覚を伝える。体が傾いているか否かを感じる神経。 ・中脳: 上丘は、視覚反射の中継所。目に光が入ったときに瞳孔を収縮させる対光反射、見ている物が近づいたときにレンズを厚くしてピントを合わせる調節反射、同時に視線を内側に寄せる輻輳反射に関わる。 下丘は、聴覚の中継所。耳から入った音の信号は蝸牛神経を通って蝸牛神経核で中継、下丘に入る。 下丘から出た信号は内側膝状体へ送られ、中継された後聴放線を作って大脳皮質に送られる。 ・黒質: 黒質-緻密部は、線条体へドーパミンを放出、線条体のD1受容体、D2受容体に作用する。 黒質-網様部は、線条体からのGABA入力(直接路)、淡蒼球内節からのGABA入力(間接路)、視床下核からのグルタミン酸入力など。軸索を運動性の視床核へ出力する。視床核は、運動性の皮質領野へ軸索を伸ばし出力している。また、上丘や脚橋被蓋核など脳幹の一部にも出力する。 ・側頭葉: 側頭葉は聴覚処理に関わりる。また、音声や文字の意味にも強く関わっている。また、記憶、認識に関わりダメージを受けると「昔のことは思い出せるが、新しいことが憶えられない」 ・島皮質: 痛みの体験や喜怒哀楽や不快感、恐怖などの基礎的な感情の体験に重要な役割を持つ。 視床を介して恒常性に関する求心性の経路から入力を受け、扁桃体や線条体腹側部、前頭眼窩野などの、他の多くの辺縁系に関連した領域に出力する。 島皮質前部は、嗅覚、味覚、内臓自律系、及び辺縁系の機能により強く関わり、島皮質後部は聴覚、体性感覚、骨格運動とより強く関わっている。 ・帯状回: 大脳辺縁系の各部位を結びつける役割を果たし、感情の形成と処理、学習と記憶に関わりを持つ部位。また、血圧、心拍数、呼吸器系の調整、共感、情動、認知機能に関わりを持つ。 ・前頭前野: 思考や創造性を担う脳の最高中枢。老化に伴って最も早く機能低下が起こる部位の一つでもある。情動・動機づけ機能とそれに基づく意思決定過程、さらに社会的行動、葛藤の解決や報酬に基づく選択など、多様な機能に関係している。 前頭前野に損傷を受けても、健忘症のような記憶障害は生じないが、「いつ、どこかで何をしなければならない」という将来の予定に関する記憶(展望記憶)の障害、あるいは情報をいつ、どこで得たのかという記憶(出典記憶 )の障害、どちらが先に起こったのかという順序の記憶の障害は見られる。 パーキンソン病の医師をはじめ研究者、医療関係者、情報開示して頂いている方々に感謝。 |
  |
新たな知見「ジストニア」新たな知見「ジストニア」の発症メカニズム
|
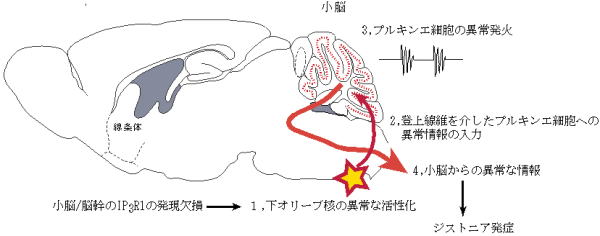 小脳/脳幹だけでIP3R1を欠損させたマウスにおけるジストニア発症メカニズムのモデル |
Braakパーキンソン病 発症 Braak仮説2003年 臨床病理的研究で発表した、Heiko Braak(ドイツの病理学者)のBraak仮説では、抗α-シヌクレイン抗体を用いて高齢者の中枢神経系におけるLewy小体(レヴューしょうたい)の分布を詳細に検討。 Lewy小体の進行 まず嗅球に出現、迷走神経背側核(延髄)、視床と、その後、下部脳幹(橋)、中脳黒質、扁桃体へ上行進展して運動症状を発現させる。 さらに前脳基底部(basal forebrain)、側頭葉皮質、大脳新皮質へと上行拡大して、精神症状など様々な非運動症状に関係すると考えられている。また、Zaccai博士の報告によると扁桃体に優位にLewy小体が分布しているとの報告もある。 Braak仮説では、嗅粘膜と腸管の上皮から病原体(neurotropic pathgen)が侵入して、Lewy小体を形成してパーキンソン病を起こす。 病原体の侵入経路・出現進展 1)嗅粘膜 → 前嗅神経核 → 海馬 → 扁桃体 → 中枢神経系へ。 2)腸管粘膜 → 粘膜下神経叢 → 副交感神経節前線維 → 迷走神経背側運動核 → 延髄 → 橋 → 青斑核 → 黒質へ。 大脳皮質では、側頭葉(前内側部) → 側頭葉(外側皮質) → 島皮質 → 帯状回 → 前頭前野。 参考文献: Braak H, Del Tredici K, Rub U, et al : Staging of brain pathology related to Sporadic Parkinson's disease. Neurobiol Aging 24 : 197-211.2003 パーキンソン病は、Lewy小体の出現に関連した神経変性疾患。 変性する神経細胞の部位 : ・パーキンソン病: 黒質、線条体、視床、橋、青斑核。 ・Lewy小体認知症: 大脳新皮質、辺縁系、扁桃核。 ・自律神経症: 末梢自律神経系。 |
  |
DATについてドーパミン トランスポーターに付いて以前よりパーキンソン病 症状、On-Off、wearing-off症状が、L-dopaを服用後4-7年後起るメカニズムを調べたかった。一説には過剰( 遊離 )ドーパミンを取り込むドーパミン トランスポーター(DAT)の機能不全とある。では、DATの機能改善をできればパーキンソン病症状の改善に一部つながるのではないか??と考え文献の 調査を行った。また 神経細胞変性に対してグルタミン酸の関与があるとの報告もある。 ドーパミンの放出量と調節 ドーパミン トランスポーター( DAT )とドーパミン受容体で調節されている。 神経細胞終末で放出されたドーパミンをドーパミン受容体で受け取り、余ったドーパミンをDATが回収することにより脳内のドーパミン放出量が調整されている。 ドーパミンが多すぎると 統合失調症、陽性の症状「幻覚」・「妄想」・「精神依存」が見られる。 コカインやアンフェタミンは、ドーパミン トランスポーターがドーパミンを回収する際、通路を塞ざすことでドーパミン回収を妨げる。その結果、DATとドーパミン受容体のあいだに回収されないドーパミンが多くなり溜り、次のドーパミン分泌(放出)とかさなり大量のドーパミンがドーパミン受容体に送くられる。 ドーパミン量が少ないと 統合失調症、陰性症状「認知機能障害」・「うつ病」・「パーキンソン病 症状」になってしまう。
|
アミノ酸からの神経伝達物質産生経路
アミノ酸から神経伝達物質 産生経路 ( アミノ酸分解代謝、分子生合成 )
| ドーパミン 産生経路 |
ノルアドレナリン 産生経路 |
アドレナリン 産生経路 |
セロトニン 産生経路 |
アミン 産生経路 |
| フェニルアラニン (必須アミノ酸) |
ドーパミン | ノルアドレナリン | 蛋白質 ( 小腸から吸収 ) |
蛋白質 ( 小腸から吸収 ) |
| ⇓⇓ フェニルアラニン -4- モノオキシゲ ラーゼ酵素 ⇓⇓ |
⇓⇓ ドーパミン -β- モノオキシゲ ナーゼ (酸化還元酵素) ビタミンCが必要 ⇓⇓ |
⇓⇓ フェニル エタノール アミン -N- 基転移酵素 ⇓⇓ |
⇓⇓ 肝臓の 酵素で分解 ⇓⇓ |
⇓⇓ クロム親和性細胞 (内分泌細胞) 酵素分解 ⇓⇓ |
| チロシン (必須アミノ酸) |
ペプチド (アミノ酸から 出来る分子) |
|||
| ⇓⇓ チロシン -3- ヒドロキシ ラーゼ 水酸化酵素 ⇓⇓ |
⇓⇓ 酵素分解 ⇓⇓ |
|||
| レボドパ (L-dopa) |
トリプトファン (必須アミノ酸) |
トリプトファン (必須アミノ酸) |
||
| ⇓⇓ ドーパ脱 炭素酵素 ⇓⇓ |
⇓⇓ トリフトファン 水酸化酵素 ⇓⇓ 芳香族 L-アミノ酸 脱炭素酵素 ⇓⇓ |
⇓⇓ 酵素分解 ⇓⇓ |
||
| ドーパミン | ノルアドレナリン | アドレナリン | セロトニン | アミン |
私見PD出現症状のメカニズム
「私見PDの出現症状メカニズム」(平成25年10月24日Report)はじめに 「パーキンソン病のお話し」ページで検索して述べましたが、短的に言いますと、大脳基底核の黒質緻密部で神経伝達物質のドーパミンが作られなくなっているか、黒質 緻密部から線条体へ繋がっている神経細胞が減少しているかが原因で、様々な症状が出現して来ると考えられています。また、神経細胞の減少によりドーパミン貯蓄能力が減少、ドーパミン産生が減少が原因として示唆されています。 この事をベースに考えて家内のパーキンソン病の出現症状(過去2年間)を振り返ってみると ①運動障害(振戦・歩行困難・下肢の固縮・上下肢の固縮・唇、顔面の固縮・無動・足首以下のジストニア) ②非運動障害(構音障害・流涎症状・幻覚、幻聴、妄想・傾眠・感覚障害・息苦しい、悪夢・胃痛・不安感・微熱・低血圧症・下肢浮腫・便秘・頭がぼんやり・認知錯誤障害(記憶障害)・REM睡眠異常行動・痰が絡む)の症状が出現している。 では、どのようなメカニズムで出現するのだろうかを調査。 ドーパミン伝達経路のドーパミン量により出現する症状 ⓐ黒質→線条体路: この経路のD2受容体が長期に遮断されることにより遅発性ジスキネジアを引き起こす。 錐体外路症状の症状が出現。 (筋緊張亢進:黒質 → 線条体 → 淡蒼球。 筋緊張低下:黒質 → 線条体 → 淡蒼球 → 視床 ⓑ大脳 → 側坐核路(報酬系): 食事の喜び、睡眠の喜び、成功した事の喜びなど生きる楽しさなどと関係。 統合失調症-陰性症状で喜びや興味の減退などの症状。辺縁系ドーパミン経路のD2受容体を遮断してしまうことにより報酬系が正しく機能しないことが原因と考えられています。 ⓒ大脳 → 皮質路(認知機能): ストレス刺激で活性化すると、前頭前野のドーパミンD1受容体を介して前頭前野の行う認知・思考・ワーキングメモリ等の機能を抑制して 背外側前頭前皮質に正しく現状を理解することや、必要な事柄を判断する認知に関与.。 ⓓ隆起漏斗下垂体路: ドーミンが阻害されるとプロラクチン濃度が上昇し、乳汁漏出症候群、無月経・インポテンツを引き起こします。 ⓔ大脳 → 間脳路: 腹側被蓋野(中脳)→ 間脳(視床・視床下部)、脊髄への投射する経路。 三叉神経脊髄路核に対する抑制に関与、レストレスレッグス症候群、下肢静止不能症候群、むずむず足症候群 (アカシジア)、入眠障害、中途覚醒の合併症。 下肢を中心に不快な異常感覚が、特に夕方から深夜にかけて出現する疾患で、かゆくなったり、痛くなったり、あるいは虫が這うような不快感を感じ、脚を動かしたいという強い欲求が起こるために不眠の原因となります。 「むずむずする」・「じっとしていられない」・「痒い」だけでなく、「ピンでなぞられているような」・「針で刺すような」・「火照るような」・「蟻やミミズなどの虫が這っているような」などの異様な感覚が現われ、時には「振動」を感じる場合もある。 その他 精神病薬はヒスタミン作用による体重増加、αアドレナリン遮断作用による心血管障害、ムスカリン性、アセチルコリン阻害による口渇、かすみ目、便秘。 以上の事より出現症状は、ドーパミン不足によりドーパミンとアセチルコリンとの不均衡、ドーパミンとGABA神経伝達物質のバランス崩れにより運動症状は、ⓐ+ⓔ。非運動症状は、ⓑ+ ⓒ+ⓔ。 により派生する出現症状と予測が出来たが、まだ説明の付かない出現症状は、薬の副作用の悪性症候群で説明がつく。まだ、気に成る点があるので後に述べたい。では、神経伝達物質の量により起こり得る症状を調査。 ドーパミン量が増えると起る症状。統合失調症の陽性症状(ドーパミンが上昇)。 思考障害:他人の質問に対し、的外れな答えを返す。考えがまとまらず話がまとまらない。 幻聴:聴覚の幻覚。(人の声、音に敏感) 幻視 : 視覚の幻覚。(存在しない物が見える) 幻嗅:嗅覚の幻覚。(臭いに敏感) 体感幻覚:体性感覚の幻覚。(皮膚・筋肉・間接で視床が関与) ドーパミン量が減少すると起こる症状。統合失調症の陰性症状(ドーパミンが低下)。 認知機能障害、記憶力、注意・集中力、計画、思考、判断、実行、問題解決などの複雑な知的能力の欠如。不安感・焦燥感・緊張感、自発性の低下(自分ひとりでは何もしようとせず、家事や身の回りの事にも自発性がない、感情の動きが乏しくなり無関心)また、なんとなく胃が痛い、病院にいって検査しても異常がないなど。 運動障害:不随意運動(筋固縮、寡動、無動、振戦、関節が硬く引っ掛かりを持つ歯車様固縮)。 アセチルコリン量が増えると起る症状。 運動障害:不随意運動(筋固縮、寡動、無動、振戦、関節が硬く引っ掛かりを持つ歯車様固縮)。 ノルアドレナリン量が減少すると起こる症状。 姿勢調節機能障害、すくみ足。 長期抗パーキンソン病薬投与で起こる症状。 ・悪性症候群: 発熱(微熱で始まることもあるが、38-40℃に至る高熱)、発汗、嚥下障害、流涎(よだれを流す)、言語障害、頻脈(脈が速くなる)、循環障害、脱水症状、意識障害、呼吸障害 、無動(身動きしない、しゃべれない)、筋固縮、 振戦。 ・ウエアリング-オフ(Wearing-off): 抗パーキンソン薬の効果継続時間が短縮し症状が変動する状態。 ・遅発性ジスキネジア: 顔の表情をつくる筋肉や口の周辺、顎、舌、さらに手足や体そのものが自分の意志とは無関係に周期的に動くようになる不随意運動症状。 ・遅発性ジストニア: 顔の表情をつくる筋肉や口の周辺、顎、舌、流涎、構音障害、さらに手足や体そのものが自分の意志とは無関係に動き硬直する不随意運動症状。 off時で起こる出現症状が主であるが、on時からoff時に向かうドーパミンの血中濃度の下降期に上・下肢は動くが、唇が前に突き出す時と構音障害が出現の時と、また、顔の固縮(無表情)からoff状態になる順序がある。 パーキンソン病の患者さんの症状は様々と聞いているが、運動症状出現に対して順序がどうも有る様に感じられる。また、服薬後onに向かう時も約1分ぐらいジスキネジアが起りonに成る時と、突然onに成る時がある。 on時でも、微妙な痺れを訴える時もある。 二相性ジスキネジア(Diphasic-Dyskinesia)の対症は無いとされているが、ロピニロール徐放剤服用して出現は減少した。(ドーパミン受容体は、まだ活動していると安堵) パーキンソン病患者には、適切量、適切な時期にドーパミンを大脳基底核に補給してやる事が大切。多すぎても副作用が出現、少なすぎればパーキンソン病症状が出現。 以上 今後、検索等を含め調べたいことは、 ①大脳前頭葉(運動野)→ 脳幹 → 中脳 → 橋 → 延髄 → 脊髄への信号伝達よりの各部位からの優先順位の 有無。 ②外的情報要因である視覚、聴覚、臭覚よりもたらされ情報により、過去の記憶(トラウマ)から扁桃体への 刺激、自律神経への影響とEMDR療法(Eye Movement Desensitization & Reprocessing)が影響する右脳 感覚野と左脳の働き。 ③線条体から淡蒼球に出力する直接路、間接路の電流の強弱(バランス)。 ④ドーパミントランスポーター(DAT)の浮遊ドーパミン回収した後、細胞内でリサイクルする細胞メカニズム。 ⑤神経細胞の維持・修復・再生が気にかかる。 パーキンソン病の医師をはじめ研究者、医療関係者、情報開示して頂いている方々に感謝。 |
ドーパミン上昇、低下した場合の症状ドーパミン量の上昇、低下した場合の症状ウェアリング-オフ(Wearing-off)症状で、ピーク ダズ ジスキネジア (peak-dose Dyskinesia)、 オフ-ピリオド ジスキネジア(off-period Dyskinesia)の非運動症状が気にかかり調査。 ドーパミン量に異常が起こることによって精神症状(統合失調症、躁うつ病、うつ病、痴呆、せん妄、薬物依存など)を引き起こされます。 統合失調症の陽性症状が表れているときはドパミンが上昇。陰性症状が顕われている時はド-パミンが低下。 陽性症状:思考障害(他人の質問に対し、的外れな答えを返す。考えがまとまらず話がまとまらない) 幻聴:聴覚の幻覚。(人の声、音に敏感) 幻視 : 視覚の幻覚。(存在しない物が見える) 幻嗅:嗅覚の幻覚。(臭いに敏感) 体感幻覚 :体性感覚の幻覚。(皮膚・筋肉・間接で視床が関与) 陰性症状 : 認知機能障害、記憶力、注意・集中力、計画、思考、判断、実行、問題解決などの複雑な知的能力の欠如。不安感・焦燥感・緊張感、自発性の低下(自分ひとりでは何もしようとせず、家事や身の回りのことにも自発性がない、感情の動きが乏しくなり無関心)また、なんとなく胃が痛い、病院にいって検査しても異常がないなど。 |
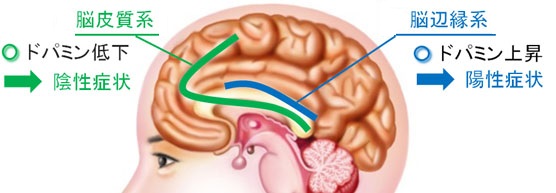 |
| 腹側被蓋野 → 中脳辺緑系 → 妄想、幻覚(陽性症状) 腹側被蓋野 → 前頭葉・側頭葉 → 意欲低下(陰性症状) |
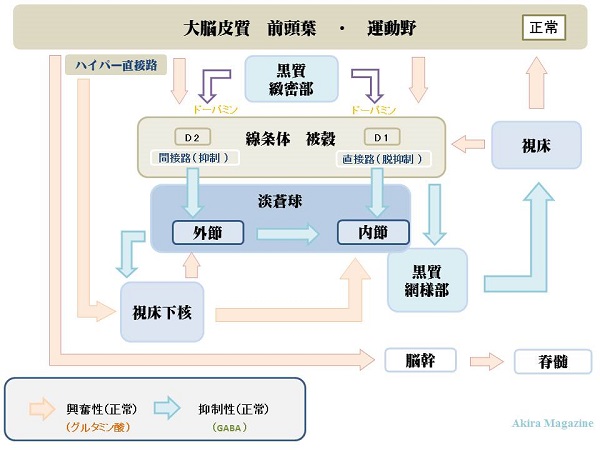
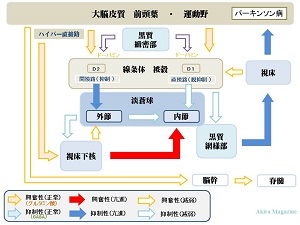
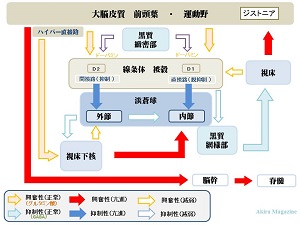
PDとジストニアのメカニズムパーキンソン病とジストニアのメカニズムパーキンソン病の出現症状とジストニア症状の違いを把握したいと考え大脳基底核 神経伝達物質ブロック図を作成し何が起こっているかをまとめました。 パーキンソン病の発症原因 黒質のドーパミン神経伝達物質の量が少なくなったため、黒質(緻密部)→ 線条体への神経細胞の変性、神経細胞の蛋白質分解異常、線条体の直接路(興奮系)、間接路(抑制系)のパランスが崩れたため等々、さまざまな説がありますが、現状 発表されている文献を参照してまとめました。まだ発症原因メカニズムは解明されていない点が多く出現症状が患者個々により異なり今後の解明に期待したい。 |
|
 |
|
 |
 |
| 正常とパーキンソン病との比較(出力) ・黒質(緻密部)→ 線条体:低下 ・線条体(D1)→ 淡蒼球(内節):低下 ・淡蒼球(内節)→ 視床:亢進 ・淡蒼球(内節)→ 黒質(網様部):正常 ・淡蒼球(外節)→ 視床下核:低下 ・淡蒼球(外節)→ 淡蒼球(内節):低下 ・視床下核 → 淡蒼球(外節):低下 ・黒質(網様部)→ 視床:亢進 ・視床 → 線条体:低下 ・視床 → 大脳皮質:低下 ・大脳皮質 → 視床下核:正常 ・大脳皮質 → 脳幹:低下 |
正常とジストニアとの比較(出力) ・黒質(緻密部)→ 線条体:低下 ・線条体(D1)→ 淡蒼球(内節):亢進 ・淡蒼球(内節)→ 視床:正常 ・淡蒼球(内節)→ 黒質(網様部):亢進 ・淡蒼球(外節)→ 視床下核:低下 ・淡蒼球(外節)→ 淡蒼球(内節):低下 ・視床下核 → 淡蒼球(外節):低下 ・黒質(網様部)→ 視床:低下 ・視床 → 線条体:低下 ・視床 → 大脳皮質:亢進 ・大脳皮質 → 視床下核:正常 ・大脳皮質 → 脳幹:亢進 |
| 運動症状の出現 Braak仮説によると、抗α-シヌクレイン抗体を用いて高齢者の中枢神経系におけるLewy小体の分布を詳細に検討し、Lewy小体はまず嗅球に出現、迷走神経(延髄)背側核(視床)と、その後、下部脳幹(橋)、中脳黒質、扁桃体へ上行進展して発現させる。 Braak仮説:嗅粘膜と腸管の上皮から病原体(neurotropic pathgen)が侵入して、Lewy小体を形成してパーキンソン病を起こす。病原体の侵入経路は、 1)嗅粘膜 → 前嗅神経核 → 中枢神経系へ。 2)腸管粘膜 → 粘膜下神経叢 → 副交感神経節前線維 → 迷走神経背側運動核へ。 |
|
前頭葉とドーパミン量について前頭葉とドーパミン量に付いて2013年2月よりCOMT錠を1/2に削減してOn状況が延長した結果を見て薬の適切な量の大切さを認識。ドーパミンに対しても現状の量が適切かが疑問になり今月6月より1日量の1/10を削減を行った。何か研究発表が無いか検索を行った結果2006年に下記内容の研究発表がなされていた。 研究発表内容 前頭前野の高次機能は神経伝達物質のドーパミン、セロトニン、ノルエピネフリン、GABA(ガンマアミノ酪酸)などによって作動が知られている。これらの物質が欠乏すると、ワーキングメモリー課題の遂行、プラニング、意思決定や反応抑制の障害を示したり、情動障害を示したりする。 ドーパミンは大脳皮質の中では前頭葉に最も多く分布しており、前頭前野の働きに最も重要な役割を果たす神経伝達物質である。ドーパミンの働きの異常に関係した病気であるパーキンソン病や統合失調症の患者は,前頭前野機能に関係した課題で成績が悪くなる。 サルの前頭前野にドーパミンの阻害剤を投与してドーパミンを枯渇させると,サルは前頭前野が関係する色々な課題が出来なくなる。一方ドーパミンは欠乏だけでなく,多すぎてもこうした課題に障害を起こす。前頭前野が効率的に働くためには,ドーパミン量がある「最適レベル」にある必要があると考えられている。強いストレスは前頭前野内のドーパミン濃度を上昇させる。一方、老化に伴って前頭前野内のドーパミン濃度は減少する。どちらの場合も認知機能は低下するが、濃度を適度に下げる,あるいは上げるような薬物を投与すると前頭前野は効率的に働くようになる。またワーキングメモリー課題の成績が良くないヒトにドーパミンの働きを高める薬物を投与すると課題成績が良くなる一方、もともと成績のよいヒトにそうした薬物を投与すると課題成績が悪くなる、ということも見られる。ドーパミンの受容体にはD1からD5の5種類があるが、認知課題に最も重要なのがD1受容体である。ニューロンレベルの研究で、このドーパミンD1受容体の作動薬を微量投与すると、投与量とワーキングメモリー関連ニューロン活動の間にも、逆U字の関数関係が認められる。すなわち適切な投与量ならS/N比がよくなることによりワーキングメモリー活動は促進されるが、投与量が少なすぎる、あるいは多すぎる場合はワーキングメモリー活動が促進されることはなく、阻害される場合もある。サルの前頭前野の外側部にドーパミンD1受容体の作動薬を投与すると、視覚連合野の刺激反応性が向上するという報告がある。これはさきに述べた前頭前野のトップダウン信号にドーパミンが重要な役割を果たすことを示す。 カテコール-O-メチル基転移酵素 (catechol-O-methyl transferase; COMT)は、ドーパミンやノルアドレナリンなどのカテコールアミンとよばれる神経伝達物質の代謝酵素である。ヒトのCOMTには遺伝子多型があり、最初のメチオニンから数えて158番目のアミノ酸がバリン(Val)の場合とメチオニン(Met)の場合がある。COMTの酵素活性は、Val型の方が高いので、前頭前野でのドーパミンの分解はVal型で早く、Met型の者は、Val型の者よりも、ドーパミン代謝が減弱している。その結果Val型のヒトは前頭前野活動が非効率的で認知課題の遂行が落ちる傾向にある。ヒトにドーパミンの働きを高める薬物を投与すると、同じ量でもVal型のヒトではワーキングメモリー課題成績が上昇するのに、Met型のヒトでは課題成績が減少する、ということも見られる。ここでも前頭前野におけるドーパミンと認知行動の間の逆U字関数関係が見られる。ただ、遺伝子多型と行動との関係は複雑であり、課題の条件やドーパミン量の操作法に関係して、いろいろな研究の結果は必ずしも一致しているわけではない。 参考文献 G V Williams, S A Castner Under the curve: critical issues for elucidating D1 receptor function in working memory. Neuroscience: 2006, 139(1);263-76 [PubMed:16310964] |











