�F�m�@�\��Q�i�F�m�ǁjDemens
�p�[�L���\���a�ƔF�m��
�p�[�L���\���a�iPD�j�ǂ��Ė�6�N��A�F�m�@�\�Ɉٕς��I�I��t�ɏǏ��`���Ă������F�m�@�\��Q�ƔF�߂Ă��炦���A9�N��摜�����ɂ�菉�߂Đf�f���ꂽ�B
�F�m�ǂɂ́A�A���c�n�C�}�[�^�A�����B���̌^�A�]���ǐ��A�O�������t�ϐ��ǁA���̑��ɃX�s���w�[�^�A�E�C���X�A�v���I���Ȃǂ̊��������q�ɂ��A�_�o�זE�����Q����ċN����F�m�ǂ�����܂��B
PD���i�s���ă����B���̌^�F�m�ǂɐ��鎖������APD���҂̔F�m�ǂǂ��郊�X�N�͌���҂̖�5�`6�{�ƍl�����āAPD���҂�40%���A�F�m�ǂ��������Ă���Ƃ̕�����A8�N�Ԃ̒ǐՒ����ŁA78%���F�m�ǂǂƂ̕�����܂��B
PD�ƔF�m��(PDD)�̒m���𑝂₵�Ǐ�𗝉��A�Ή����邱�ƂŁAQOL�̌��オ�}�邱�Ƃ��\�ł��B
Page Contents�@�i�ڍׂ͉������N���b�N�j
�@�@�@�@�E�F�m�@�\��Q�@�@
�@�@�@�@�EPD�E���_�Ǐ�ƔF�m�ǂ̊W���@
�@�@�@�@�EPD�i�s�ɔ��������B���̌^�F�m��
�@�@�@�@�EPD�E�F�m�ǂ̐f�f�E�����@�@
�@�@�@�@�E�F�m�� ���@�@
�@�@�@�@�E�u�A���c�n�C�}�[�a�v�V���Ȓm���@�@
�@�@�@�@�E�F�m�ǂ̗\�h
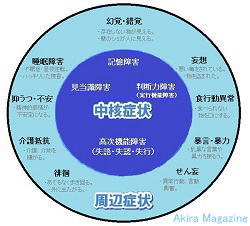
�F�m�@�\��Q�F�m�@�\��Q�i�F�m�ǁj�F�m�@�\��Q�Ƃ́H�H�@�F�m�@�\��Q�Ƃ́A�u�m�\����V�I�ɒቺ������ԁv���w���A�]�̏�Q�������I�ɒቺ���i�s�������Q�B �@�Ǐ�͒��j�Ǐ�Ǝ��ӏǏ�iBPSD)�ɕ��ނł��܂��B �@�����͕s���ŁA�A���c�n�C�}�[�^�A�����B���̌^�A�]���ǐ��A�O�������t�ϐ��ǁA���̑��ɃX�s���w�[�^�A �@�E�C���X�A�v���I���Ȃǂ̊��������q�ɂ��A�_�o�זE�����Q����ċN����F�m�ǁA�ጌ���������N���� �@�F�m�ǂ�����܂��B �@�܂��A�p�[�L���\���a���i�s���ă����B���̌^�F�m�ǂɐ���Ǝ�������Ă��܂��B �����E�v�� �E�A���c�n�C�}�[�^�̌����͕s���ł����A�A�~���C�h���`�����̋ÏW�ɂ��_�o�����ەω����A�_�o�זE�� �@�ւƎ���Ƃ��A�~���C�h�J�X�P�[�h�����嗬�B�܂��A�_�o�����ەω����\�����郊���_�����ꂽ�^�E�`������ �@���ڂ��闧����L�͂ł��B�^����Q�͈�ʓI�ɏo�����Ȃ��B �E�����B���̌^�̌����́A���V�k�N���C���`�����̋ÏW�i�����B���́j�ƍl�����A�o������]���ʂ� �@�@�@���������s����^�C�v�A �@�@�A�G���j�����]�玿�A�]���i�W����^�C�v�A �@�@�B��]�玿����]�������ɉ�������^�C�v���l�����Ă���B �E�O�������t�ϐ��ǂɂ��ẮA���ƂȂ�]���\���������炩�ɂȂ���茴���𖾂����҂���Ă��܂��B �E�]���ǐ��̌����́A�]�̌��ǂ��l�܂�����j�ꂽ�肵�đ�]�[���̔������ۂ̘A���@�\���f����邱�ƂŔ]�� �@�E�����ł��ĔF�m�ǏǏ�A�^����Q���o���B�܂��A�C�n�A�����A����j�ȂǏd�v�Ȕ]���ʂɍ[�ǂ����ǐ� �@�ł����Ă������]�@�\��Q���������B �Ǐ� ���j�Ǐ��i�F�m�@�\��Q�j�ɂ́A �@�@�L����Q�F�������Ċo�����藝�������肷��\�͂��ቺ�A�̌��������Ƃ��ۂ��ƖY��Ă��܂��A�Â��o���� �@�@���V�����o������Y���X�������L��B �A�@��������Q�F���t�A���Ԃ�ꏊ�A��ԂȂǂ�������Ȃ��A�������u����Ă���𐳂����F���ł��Ȃ��B �B�@���f�͏�Q�i���s�@�\��Q�j�F�v�l�͂┻�f�͂��ቺ���A������_���I�ɏ������Ăčl�����Ȃ��B �C�@�����@�\��Q(����E���F�E���s)�F �@�@�@1.�����F���b�ʂ̌����A�\����Q�B �@�@�@2.���F�F���o�I�ɒ������̂�����Ȃ��A�n�}���`���Ȃ��B �@�@�@3.���s�F�ߕ��������Ȃ��A�w�����ꂽ�s�����o���Ȃ��B ���ӏǏ��i�S���Ǐ�A�E�}���A�s���ُ�Ǐ�j�ɂ́A �@�@�ϑz�E���o�E���o�F��Q�ϑz�A���݂��Ȃ�����������A���ۂƂ͈قȂ�Ώە��̑��݁A���ۂ�����B �A�@������Q�F����t�]�E�s���B �B�@�H�s���ُ�i�ِH�j�F�H�ׂ��Ȃ��������ɂ�����A���ېH�ׂĂ��܂����B �C�@�p�j�F���Ă��Ȃ��A���낤��ƕ����܂��B �D�@����R�F����������B �E�@�\���E�\���F���\�Ȍ��t��\�͂��ӂ邤�B �F�@�s���ǁE�}�����F���_�I����s����ɂȂ�B �G�@������F�ӎ���Q�ŕs��������o�A���o���ُ�s���A�����A������������B �i�s����Ɩ��o��k�o�A�Ɋo�Ƃ������m�o�ɏ�Q���N���Ă��邱�Ƃ�����܂��B 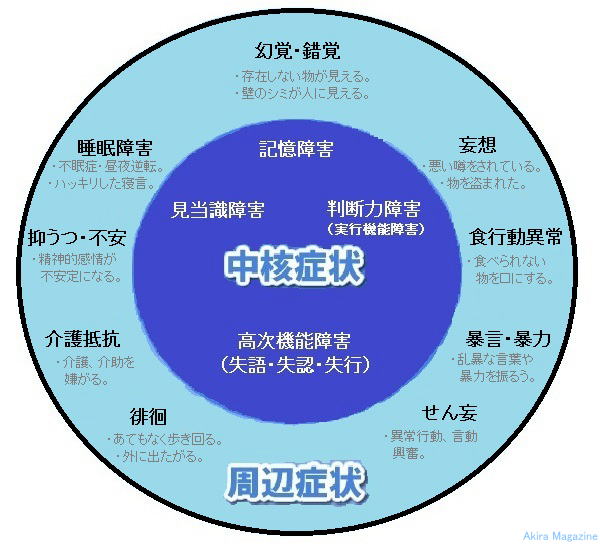 |
�F�m�@�\��Q�̕����@�i�ϐ����F�m�ǂƔ]���ǐ��F�m�ǂɕ��ނł��܂��j �E�ϐ����F�m���ɂ́A�A���c�n�C�}�[�^(AD)�A�����B���̌^(DLB)�A�O�������t�ϐ���(FTLD)�A�F�m�ǂ� �p�[�L���\���a(PDD)���Ő_�o�זE�ϐ��ŋN����F�m�ǁB �E�]���ǐ��F�m��(VD)�́A�]�[�ǁA�������������ߕa�ςŋN����F�m�ǁB �F�m�NJ��҂̊����́A�A���c�n�C�}�[�^44���A�����B���̌^21���A�O�������t�ϐ���15���A�]���ǐ�10���A���̑�10���ƌ����Ă���B ���ށE��f ���߂̓A���c�n�C�}�[�^�������̂ɓr�����烌���B���̌^�Ɉڍs����P�[�X�������A�����B���̌^�ƃs�b�N�a�A���邢�̓A���c�n�C�}�[�^�Ɣ]���ǐ��̍����^�ȂǁA���܂��܂ȃ^�C�v������܂��B �����B���̌^�̓A���c�n�C�}�[�^��p�[�L���\���a�ƁA�܂��B�s�b�N�a�i�O�������t�ϐ��ǂ̈�Ńh�[�p�~���ߏ�j�͐��_�a�Ƃ悭��f����₷���B �F�m�@�\��Q�̓���
�p�[�L���\���a�ł͐��s�@�\��Q�A�L���A����@�\�A���Ӌ@�\�A���o�F�m���i�L���E���m�o�E���s�@�\�j�̍����]�@�\�ɏ�Q�������邪�A�^���ǏO�ʂɗ����߂ɋC�t����ɂ����B�Â��̓p�[�L���\���a�ɔF�m�ǂ͍������Ȃ��Ƃ���Ă������A�ŋ߂̌����ł͐f�f��12 �N��60���A20 �N��ɂ�80���ɔF�m�ǂ�������Ƃ����B �p�[�L���\���a�ɔ����F�m�ǂł́A�����⎋��ԔF�m��Q�A�v�l�ɖ����A�����B���̌^�F�m�ǂƗގ������nj��F�߂�B�W�]���ʂ́A�����t�A�����t�A�㓪�t�ƍl�����Ă��܂��B �F�m�ǂ̎��Î菇 ���n�r���e�[�V�����i�ȉ��A���n�j���s���i�]��������������j�B��̓I�ɂ́A �@�@�@�u�y�������Ԃ̋��L�v���h���B �@�A�@���҂Ƃ̃R�~�j�P�[�V�����B �@�B�@�����Ɛ��������̕��^�B �ŁA���n�ɂ́A�o���f�[�V�����Ö@�A���A���e�B�I���G���e�[�V�����A��z�@�A���y�Ö@�A�F�m�h���Ö@�A�^���Ö@�Ȃǂ̐S���Љ�I�Ö@������܂��B �F�m�ǂ̃P�A �����v���d������P�A�B�Ⴆ�A�u���s���v���N���������A���̐l�̐S�̕\���Ɖ��߂��ĈӐ}�Ƃ��邱�ƁA �i����������c�����A�{�l�̗���őΉ�����B ���j�Ǐ�ɑ���� �Ö@�Ƃ��ẮA�R�����G�X�e���[�[�j�Q(ChEI)��������Ă���B ���ӏǏ�iBPSD�j�ɑ��鎡�� ��������A���҂ɉe������Ǐ��ΏۂƂ���B�Ⴆ�A�ϑz�A���o�A�����A�U�����A���сA�s�����B ���Âł́A���_�Ɗ댯���������ɓ����B���Ƀ����B���̔F�m�ǂł͐��̊O�H�ǂ��܂ߖߕq������ ���ӁB �F�m�ǂ𗈂��������ł́A�~�N���[�k�X�A�A�e�g�[�[�A�����^���A�s���Ӊ^��������l���B �Q�l�����F �F�m�ǎ������ÃK�C�h���C��2010�A�R�E�m���\�b�h�AClinical Rehabilitation�W���[�i�������A�y�щ��ҁB |
PD�E���_�Ǐ�ƔF�m�ǂ̊W��PD�E���_�Ǐ�ƔF�m��Q�̊W��2013�N4��13�������uClinical Rehabilitation�v�W���[�i��22��4���u�����o�߂ɂ�����p�[�L���\���a�̍���Ǐ�ւ̑Ή��@�h���_�ǂ̍����h �v�ɕt���Ă̏q�ׂ��Ă����̂ňꕔ���Љ�����B���ҁF�a�̎R������ȑ�w�_�o���ȋ����@�u�t�F�A�� ����@�@�����F�ɓ��G�� ���҂Ƃ��Ēm���Ă���Εs�v�ȐS�z�������Ȃ�����A�Ώǂ������Ȃ�B �p�[�L���\���a�̐��_�Ǐ�ɂ͂ǂ̂悤�Ȏ�ނ����邩�H�H �p�[�L���\���a�ɔ����Đ����鐸�_�Ǐ�ɂ͐�����Q�A�}���A�A�p�V�[�A���o�E�ϑz�E����ρA�F�m�@�\��Q�A�Փ������Q�A�h�[�p�~�����ߏ�Q��������BREM �����s����Q�̂悤�ɉ^����Q�������ȑO����o������Ǐ�����邪�A�����͎����̐i�s�ɔ����ĕp�x�������Ȃ�A�a���a���ɉ����đ��߂ɍ����ǂ̐�������{�l��Ƒ��ɍs���Ă����Ƃ悢�B �F�m��Q�E�F�m�ǂƂ́H�H �p�[�L���\���a�ł͐��s�@�\��Q�A�L���A����@�\�A���Ӌ@�\�A���o�F�m���i�L���E���m�o�E���s�@�\�j�̍����]�@�\�ɏ�Q�������邪�A�^���ǏO�ʂɗ����߂ɋC�t����ɂ����B�Â��̓p�[�L���\���a�ɔF�m�ǂ͍������Ȃ��Ƃ���Ă������C�ŋ߂̌����ł͐f�f��12 �N��60���A20 �N��ɂ�80���ɔF�m�ǂ�������Ƃ����B�p�[�L���\���a�ɔ����F�m�ǂł́A�����⎋��ԔF�m��Q�A�v�l�ɖ����A�����B���̌^�F�m�ǂƗގ������nj��F�߂�B�W�]���ʂ͑����t�A�����t�A�㓪�t�ƍl�����Ă��܂��B ����ԂƃA�p�V�[�Ƃ́H�H ���̓p�[�L���\���a���҂̐����`�����ɔF�߂��p�x�������B�p�[�L���\���a�̂��͑傤�a�ɔ�ׂĔ߈�����߈����A���E�O���������Ȃ��B�A�p�V�[�͓��@�Â������@������ԂŁA�u�����E�S�̑r���v�u���C�̂Ȃ��v�������ł���B���̕����Ǐ�ł���ꍇ�ƁA���Ƃ͓Ɨ����Đ�����ꍇ������B ����ρE���o�Ƃ́H�H �i�s���̃p�[�L���\���a�ł͍��p�x�ɂ���ς⌶�o���݂���B���o�͐l���⏬�����̌����������A�{�l�Ɏ��o������A������ُ�s����Ȃ��^�C�v�͎������̂��̂ɂ����̂ƍl�����A��ܓ��ɂ��ϋɓI�ȉ���͓���B�ނ���{�l��Ƒ��ɗǐ��̂��̂ł���Ɠ`���A�Ǐ�Ƃ̋�����}�����ق����悢���A�S�g��Ԃ̈������܂̕���p�ɂ����́A�܂��ُ�s���⋻�����ꍇ�͑S�g��Ԃ̊Ǘ��⌵���Ȗ�ܒ��߂��K�v�ł���B �p�[�L���\���a�̂����Ȕ�^���Ǐ� �E�֘A�����炩�Ȃ��́F �@�k�o��Q�A�֔�A������Q[�����X��(ESD)�A�˔��I�����A�s���ǁAREM�����s���ُ�(RBD�j] ���y�� �@�s���ǁB �E�֘A����������Ă������ �F �@�����_�o��Q�A���͏�Q�A�F�m�@�\�ω��A�A�p�V�[�A��J�A���i�ω��B �Q�l�����FClinical Rehabilitation�W���[�i�������A�y�щ��ҁB �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@  |
PD�i�s�ɔ��������B���̌^�F�m��PD�i�s�ɔ��������B���̌^�F�m�ǁiDLB)�����B���̌^�F�m���i�����B���傤���������ɂ��傤: Dementia with Lewy Bodies�F DLB�j�B�i�s���̔F�m�@�\��Q�i�ϐ����j�ŁA�A���c�n�C�}�[�^�F�m�ǂ�]���ǐ��F�m�ǂƕ��юO��F�m�ǂƌĂ�� ���܂��B�����͐��_�Ǐ�ƃp�[�L���\���nj�Q�̏Ǐo���B�p�[�L���\���a�iPD�j���҂�40%���A�F�m�ǂ� �������Ă���Ƃ̕�����A8�N�Ԃ̒ǐՒ����ŁA78%���F�m�ǂǂƂ̕�����܂��B�����B���̌^�F �m�ǁiDLB�j�ƔF�m�ǂ��p�[�L���\���a�iPDD�j�Ɂ@���ނ���Ă��܂��B�@�Ǐ�́A ���j�Ǐ��F�L����Q�A�F��������Q�A���Y����B ���ӏǏ��F �F�m�@�\�̓��h�A�����A�����A�ϑz�A�p�[�L���\���nj�Q�B �E�F�m�@�\�̓��h�Ƃ́A�����n�b�L�����Ă��鎞�ƃ{�[�Ƃ��Ă��鎞�̗l�ɔF�m�@�\�ϓ��������A���Ԃɂ�� �@�N����B �E�����́A���݂��Ȃ��l���⏬�����������A�������ŋ�̓I�ŏڍׂȓ��e�̂��́B�܂��A���o �i���l�ԂɌ�������A�ǂ̂��݂���ɂ݂�����A�Ώە����ʂ̂��̂Ɍ����錻�ہB�Ώە����₵�݂ł���A �@���ꂼ��l�Ԃ��ł͂Ȃ��Ɨ������Ă��邪��x�����v���ƁA�ǂ����Ă��l�Ԃ��Ɏv���Ă��܂��j�ƘA���� �@������B �E�p�[�L���\���nj�Q�́A���Î��U��A�Ǔ��A�،ŏk�A�p�����ˏ�Q�A���s��Q�A�ዅ�^����Q�B �����Ǐ��F ���������s����Q�A�R���_�a��ɉߕq�A��]���j�ł̃h�[�p�~���g�����X�|�[�^�[��荞�ݒቺ�B �E���������s����Q�Ƃ́A���i�؋ْ��̗}�����o�����ُ�ȃ����������N��B �@�i���X�������������ĐQ���A�吺�ŋ��ԁA�����s���j �E�R���_�a��ɉߕq�́A�R���_�a�^�ɑ��ăp�[�L���\���nj�Q�̋}���ȏo������A������Q�A�ߒ��ÁA �@�ӎ���Q�A�����nj�Q�Ȃǂ̉ߕq���������B �x���Ǐ��F �}����ԁA�����_�o�Ǐ�i�N�����ጌ���A�H��ጌ���A��łȕ֔�A�����j�A���_�A��ߐ��̈ӎ���Q�i���_�Ɋւ��Ă͔]�����⎩���_�o�n�̋@�\�ُ�ɂ���Đ���������_�o���ˏ�Q�j �a���w�ł́APD �� PDD �� DLB�ƘA�����������A�����B���̂̏o���� �@�@���������s����^�C�v�A �@�A�G���j�����]�玿�A�]���i�W����^�C�v�A �@�B��]�玿����]�������ɉ�������^�C�v���l�����Ă��܂��B �i���㌛�i�炪1995�N���� �т܂u�����B���̂����肳�ꂸ�ɍL�͈͂ɍL�����Ă����ԁv�̔F�m�ǂ� �@�����B���̌^�F�m�ǂł��j �������璍�ӏ�Q�A����ԏ�Q�A�\����Q�A���s�@�\��Q�Ȃǂ̑O���t�E�����t��Q�ɋN������Ǐ���B �F�m�@�\��Q�̎��Ö��F �A�Z�`���R�����_�o�̋N�n�j�ł���}�C�l���g���j�Ő_�o�E�����A���c�n�C�}�[�^�F�m�ǁiAD�j�������x�ł���A�a�Ԑ�������R�����G�X�e���[�[�j�Q���DLB�̔F�m�@�\��Q�ւ̌��ʂ����҂ł���B DLB�ł̓R�����G�X�e���[�[�j�Q��ɑ��Ă����̊O�H�Ǐ�⎩���_�o�Ǐ�A���_�Ǐ�̑����Ȃljߕq���������������邪�A���̂悤�ȗ�͏��Ȃ�ATD�Ɠ��l�̓��^���@�Ŗ��͂Ȃ��ƍl�����Ă���B �܂�NMDA��e�̝h�R������}���`����RCT���s���Ă���L���Ƃ������ʂ��o�Ă���B �E�R�����G�X�e���[�[�j�Q��i�h�l�W���j�F �@�����A�q�C�A�H�v�s�U�Ȃǂ̕���p������Ă��邪�p�[�L���\�j�Y���̑����͂قƂ�ǔF�߂��Ȃ��B �ENMDA��e�̝h�R��i�A�}���^�W���j�F �@���}���`���������_������r����(RCT)���s���Ă���L���Ƃ������ʂ��o�Ă���B �E�}�̎U�i�悭����j�F �@��������_�o�ǁA�s���ǂ⌶�o�ɗL�������L��Ǝ�������Ă���B �i�Z���g�j���_�o�n�̃o�����X���A�O���^�~���_�_�o�n�̉ߊ�����h�~�j�B �@���ɃK�����^�~���A���~�j�[���A���o�X�`�O�~���A���o�X�^�b�`�p�b�`�A�C�N�Z�����p�b�`���p������ �@���܂��B 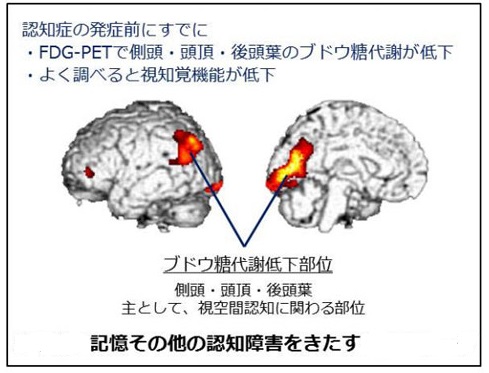
|
PD�E�F�m�ǂ̐f�f�E����PD�E�F�m�ǂ̐f�f�E����PD�E�F�m�ǂ̌��������t�̖�f�̌��ʂɂ�茟�����s���܂����A�ߔN�APD�������i�����܂����B�����̎�ނ��Љ�܂��B �EPD���O���� ���t�����A�A�����AMRI�ACT�X�L���[���A�����匟���ňُ킪���������m�F�B �i���A�]��ᇁA���A�a�A���̎��������������m�F�j �EUPDRS�X�P�[�� �p�[�L���\���a�𑍍��I�ɕ]�������Ƃ��āA���E���̌����҂��t�ɍL���ǂ��p�����Ă��܂��B ���[���d�Ǔx���ނɔ�ׂĂ͂邩�ɍׂ����]�����邱�Ƃ��ł��܂��B �EMIBG�S�V���`�O���t�B�[���� MIBG�̏W�ς��S�ɍ��x�ɒቺ���Ă���ꍇ�A�S���̌����_�o�@�\�̒ቺ���^���APD�A�����B���̔F�m�ǂ̏����ƂȂ�B �E�摜�X�y�N�g����(SPECT�Fsingle photon emission CT�j �@CT�ł͕\�킹�Ȃ������]�̌����ʂ��Ӌ@�\�̏������B �EDAT-scan���� �]���ʂ̐���� �� �����̃h�[�p�~���g�����X�|�[�^�iDAT�j�̖��x���ቺ���Ă����ǂ�����������B �iPD�A�����B���̔F�m�ǂł́ADAT�̖��x���ቺ���Ă���j�F�m�@�\�����̌����B �p�[�L���\���a���҂�L-dopa��150mg�A300mg�A600mg/���ɕ���1�N�Ԃ̊ώ@���Ԍ�A�Տ��Ǐ�ƁA�]�@�\�摜���r�������ʂł�600mg/���݂̂ŁA����̂ɂ�����L�ӂ�I-�� CIT�܌����̒ቺ�������B �EPET�����i�z�d�q���˒f�w�B�e�j SPECT�����Ȃ�����������ӂȂǂ̗l�q�𐳊m�ɔc���ł��A�]�̓����̃u�h�E����A�~�m�_�̑�ӁA�_�f�̏���ʂ̕ω��ׂāA�]�@�\�̏�Q���ʂ�f�邱�Ƃ��ł��܂��B �܂��A�]�����̕a�ԉ𖾂�����Ȏ�ᇂ̔����ɂ͌��ݍł��L���Ƃ���Ă��܂��B����ɁA�_�o�`�B�����Ƃ��̎�e�́i���Z�v�^�[�j�𑪒肷�邱�ƂŁA���_�a�̕a�Ԃ̉𖾂ɂ��𗧂B �i���{�ɂ����Ă�2015�N3�����݁A�ی��K���O�j �L����Q���� �E���J�쎮�F�m�ǃX�P�[���iHDS-R�j�FPD�̏ꍇ�A��r�I�����_�������߂��B �E�E�F�N�X���[���m�\�����F�ڍׂȌ������s���ƔF�m�@�\��Q�����炩�ɂȂ�B �@�@�@�@�@�@�@  �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@(�������u)�@�@ |
�F�m�ǖ��F�m�� ��@�F�m�ǂ̖�̎���R�����G�X�e���[�[�j�Q��ANMDA��e�̝h�R��A�}�̎U�i�悭����j�A�C�N�Z�����p�b�`���p������ ���܂��B �E�R�����G�X�e���[�[�j�Q(ChEI)��̎��
�ENMDA��e�̝h�R���i�A�}���^�W���j ���}���`���������_������r����(RCT)���s���Ă���L���Ƃ������ʂ��o�Ă���B�܂��A������Q�ɂ����ʂ��L��Ǝ�������Ă���B�i��]�Ӊ��n�A�O���t�@�\�̊�������p�j �E�}�̎U�i�悭����j ��������_�o�ǂ�s���ǂɗL�������L��Ǝ�������Ă���B �i�Z���g�j���_�o�n�̃o�����X���A�O���^�~���_�_�o�n�̉ߊ�����h�~�j�B �����ْ̋��A�z���A��s���A�s���A�����_�o�����ǁA���̓��ǁA�i�s�����A���c�n�C�}�[�^�F�m�ǂŋN����ϑz��A�p�j�i�͂������j�A�\�͂Ȃǂ̗}���ɂ����\������B �F�m�@�\��ቺ�����₷����� �E�R�p�[�L���\���a��A�E�R�Ă��A�E�z��a��i�~����A�R�s������A���A��A�W�M�^���X�j �E���ɖ�i�I�s�I�C�h�ANSAIDs�j�A�E���t�玿�X�e���C�h�A�E�R�ۖ�A�E�R�E�C���X��A�E�R���A �E��A��a��i�ߊ����N�����Ö�j�A�E������a��iH2��e�̝h�R��A�R�R������j�A�E�R�A�����M�[�� �@�i�R�q�X�^�~����j ���Ö�ɒ��� �F�m�ǂ̈�ʓI�Ȗ�Ƀh�l�W���i���i���F�A���Z�v�g�j���������܂����K�Ɏg���Ό��ʓI�ȗǖ�ł����A�A���c�n�C�}�[�^�F�m�LjȊO�̔F�m�ǂɎg���ƁA�t�ɏǏ������������댯�����傫���Ǝw�E�������� ���܂��B �i�č��H�i���i�ǁiFDA�j�́A�A���Z�v�g��]���ǐ��F�m�ǂւ̌��\�lj������F���Ă��܂���j���������� �Ǐ�Ƃ��ẮA�{����ۂ��Ǐ�A�\���A�\�͂��o�����鎖������B �����B���̌^�ŁA�葫�̊߂��X���[�Y�ɓ����Ȃ��u�،ŏk�v�̂��銳�҂ɁA�A���Z�v�g��������������ƕ��s ��Q�A�Q������A������Q�ɂȂ���\�����傫���Ǝw�E����Ă��܂��B�܂��A���o��ϑz�Ȃǂ̐��_�Ǐ� ���������Ǝw�E�����������܂��B �Q�l�����F�F�m�ǎ������ÃK�C�h���C��2010�A�R�E�m���\�b�h�̔����A�y�щ��ҁB �@�@�@�@�@�@�@�@�@�@�@�@�@ 
|
||||||||||||||||||||||||||||||||||||||||||||||||||
| �u�A���c�n�C�}�[�a�v�V���Ȓm�� �u�A���c�n�C�}�[�a�v�V���Ȓm���A���c�n�C�}�[�a�F�m�ǂ̓���́A�A���c�n�C�}�[�a 68%�A�]���ǐ��F�m�� 20%�A�����B���̔F�m�� 4%�i�����J���� �����ǔ��\�j�ƍł������^�C�v�̔F�m�ǂł��B �A���c�n�C�}�[�a�̎匴���́A�]�̊C�n�̈ޏk���甭�ǂ���Ǝ�������Ă��܂��B�₪�đ�]�玿�̈ޏk���i�ޕa�ŁA�L����Q�A�_���I�Ȏv�l�ɉe�����y�ڂ��܂��B�ޏk�ɑ��Ă̕a���́A�_�o�זE�̕ϐ��ɂ��N����܂��B �ϐ��̌����́A�_�o�זE�����債���A�~���C�h���`���������~�i�ł܂�j�_�o�זE�̃V�i�v�X��j�āi�A�~���C�h���`�����̌ł܂�̓V�i�v�X�ɂƂ��ēŐ���L����j�A���̌�A�_�o�זE�̒��Ƀ^�E�`�������ϐ��������i�_�o�����ەω��j�ɂ��_�o�זE���ϐ����s���C�n�̈ޏk���n�܂蔭�ǂ���ƕ���āA�A�~���C�h���`�����̒~�ς́A���ǑO25�N�O�A�^�E�`�����̒�����15�N�O�A�C�n�̈ޏk�́A5�N�O����n�܂蔭�ǂ���ƕč����V���g����w�����[�_�[�Ƃ���DIAN�����`�[�����������Ă��܂��B �i�s��x�点�邽�߂̖� �E�V���X�^�]�[�����F �]�[�ǂ�h���V���X�^�]�[�����A�A���c�n�C�}�[�a�̐i�s��80%�x�点�鎖�i�}���j�������B�����z��Z���^�[�ɂ�錤���ŃA�~���C�h���̒����������������Ƃ��m�F�B�A�~���C�h���́A�_�o�זE�������Ɣ������ĘV�p���ŕ��ʂ͌��t�ɔr�o����܂������ǂ̕ǂ̒��ɗ��茌�ǂ̋@�\�������_�o�זE�ɉh�{�f���������ꂸ�_�o�זE�����Ɏ���܂��B���̎��ɂ��C�n�A�]�̈ޏk��������A���c�n�C�}�[�a�ǁA����������B�V���X�^�]�[���ɂ͌��ǂ̋ؓ��Ɏh�������������������ɂ�藭�܂����A�~���C�h����r�o���Ă����ƍl�����Ă��܂��B �E�C���X�������F �C���X�����͓��A�a�̖�ŗǂ��m���Ă��܂��B�i�A���c�n�C�}�[�a�͔]�̓��A�a�j�]���̃C���X�����̓����������Ȃ�זE��������荞�߂Ȃ��Ȃ�G�l���M�[�s���ƂȂ�_�o�זE�����ʂƂ̍l���ŁA�A�����J�̃��V���g����w�i�Z���g���C�X�j�Ŕ]�̓��A�a�ƍl���������i��ł��܂��B�܂��A�A�����J�̃E�G�C�N�t�H���X�g��w�i�E�C���X�g���Z���[���j�ł́A�k�o����C���V����������荞�ނ��Ƃɂ����P�����鎡�Â��i�߂��A�C���X�����̓��^�������҂ł̓A���c�n�C�}�[�a�̐i�s��}����ꂽ�Ǝ����B �C���X�����̓��^�o�H �E�k�S�� �� �O�k�_�o�j �� �C�n �� ��]�玿�ցB �i�]���t�֖��ʉ߂ł��镪�q��500�ȉ��̂��ߚk�o�����蓊�^�j�j �Q�l�F �E�F�m��800���l�̎���u�F�m�ǂ������~�߂�v�i NHK�X�y�V�����A2014�N7��20����� �j ![�A���c�n�C�}�[�a���҂̑�] �A���c�n�C�}�[�a���҂̑�]](Alzheimers1_2.jpg) �@�@�@�@�A���c�n�C�}�[�^�F�m�ǂł͑�]�玿�A�C�n�̈ޏk�A����ё��]���̊g�傪������悤�ɂȂ�B |
| �F�m�ǂ̗\�h �F�m�ǂ̗\�h�i�h�{�ێ�E�y�^���E�����j���ǃ��X�N���グ��v�f�������E���A�a�E�^���s���ŕ����̋����l�����ǃ��X�N�������ƌ����Ă��܂��B �������Ɠ��A�a�͖�2�{�A�^���s���ŕ����������l�͖�3.5�{�ƌ����Ă��܂��B �^���s���ɂ�胊�X�N���オ��̂��́A�ؓ��̎h�������Ȃ����ߔ]���̌��������Ȃ����邽�߂ƍl�����A�����K�������ǂ̃��X�N��������ƍl�����܂��B �h�{�f�̐ێ�Ŕ]�̊��������ė\�h �F�m�ǂɗǂ��Ƃ����h�{�f�ɕs�O�a���b�_�i�I���K3�E�I���K6�j�B���̎��b�_�́A�̓��ł͍��o����Ȃ� ���Ƃ���A�H���Ȃǂ�ʂ��ĊO����₤�K�v������܂��B �I���K3�́A�̓���EPA��DHA��ӂ���ADHA�͔]���ɉ^��~�ς���܂��i�]�̊C�n�ƖԖ��ɑ�ϑ����܂܂� �Ă��čזE�����_�炩���Ȃ�j�B�܂��A�]�̒��ł̓��������Ƃ��đ��݂��čזE���̌`���ɏd�v�Ȗ������ʂ� ���Ă��܂��B�ߔN�̌����ł́A�A���c�n�C�}�[�a��T�a�Ƃ��֘A������Ƃ̎w�E����Ă��܂��B �I���K6�n�́A�O�H����H�i�ɑ����g���Ă��Ĉӎ������ɐێ悵�Ă��鎖�������ł��B �I���K3�n1�I���K6�n4�̐ێ抄�������z�I�ȃo�����X�ł��̂ňӎ����Đێ�B ��̓I�ɃI���K3���܂܂ꂽ�H�ނ́A�V�\���A�E�A�}�j���E�G�S�}���E�؎���E�T�t�������ȂǂɊ܂܂�� ���܂��B ������̕K�v�Ȃ̂��A�I���C���_�i�I���K9�j�ł��B �I���K9�́A�]�̌����𑣂���p���L�蓮���d���̐i�s��\�h����Ǝ�������Ă��܂��B��̓I�ȃI���K9�� �܂܂ꂽ�H�ނ́A�I���[�u���E�p�[�����E�؎���E���ߖ��E�R�R�i�b�c�I�C���ȂǂɊ܂܂�Ă��܂��B �@�ێ悷�钍�ӓ_�Ƃ��ĉߏ�ێ�A�I���K3�̊܂܂ꂽ���́A���M��NG�A�I���K9�́A���MOK�B �����āi�^���j�E�]�̊������ŗ\�h �E������傫�����ĕ����B �E�����Ȃ�������Z�����ĕ����i��F100-7=93�A93�|7��86��5��ȏ�����Z���s���j �E�����Ŗ�3���ԕ����A�ċz���������瑁���ŕ����̔����B �ؓ��Ɏh����^��������ǂ����鎖��2�������ɍs�����N�������Ŕ]�����������s���B �����ŗ\�h �A�~���C�h���`�����i�]�̘V�p���j���]�̊C�n�ɖ�15�N�ȏ�~�ς���_�o�זE���������鎖�ɂ��]���Ϗk���� ���ɂ��A���c�n�C�}�[�^�F�m�ǂ���������Ɖ����Ă��܂����B�A�~���C�h���`�����͐����̊Ԃɗn���鎖�� �m���Ă��܂��B�܂��A��������鎖�ɂ��זE�̏C���A�L���̒蒅���s���Ă��܂��B �N��ɂ����ʓI�Ȑ������Ԃ͈قȂ�܂���40��Ŗ�7���ԁA50��ȏ�Ŗ�6���Ԃ̐��������悤�ɂ��� ���傤�B �]�k�ł����A ���������Ȃ��ƌ��ǂ����k���ĐS�����������Ȃ茌���������茋�ʓI�ɍ������ǂɂȂ郊�X�N�� �オ��A�܂��A���a�A���A�a�ɐ���₷���Ƃ̕�����܂��B �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@  �@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�I���[�u�����g�����n���C���� |











