パーキンソン病を知ろうParkinson'disease
パーキンソン病とは?

パーキンソン病 (PD)の日本での有病率は、人口1,000人当たりに約1人と言われており、日本全体で12万人以上の患者さんがいると推定されていますが、近年15万人以上とも言われています。今後、ますます増えると予想されており、わが国では難病(
特定疾患 )に指定されています。主に40歳から50歳以降に発症することが多く、ゆっくりと進行していく神経変性疾患です。
神経伝達物質の一つであるドーパミンの産生量が減少する事で起こると考えられていて減少する事により他の神経伝達物質のバランスが崩れ運動症状、非運動症状が出現。根本的な治療法は2020年現在まだ確立していません。
現状行える治療は、対症的療法 ( 症状を緩和するための治療法 ) のみです。また、類似した病に薬剤性パーキンソンニズム、パーキンソン症候群が知られています。
Page Contents (詳細は、下部をクリック)






パーキンソン病の分類
パーキンソン病の分類
孤発性、若年性、家族性があり最も多いタイプは、孤発性パーキンソン病と言われています。 孤発性パーキンソン病は、 40歳から50歳以降に発症が多く、進行する原因不明の神経変性疾患です。 原因は、中脳 黒質-緻密部の神経伝達物質の1ッであるドーパミン量が減少する事で起こると考えられていま す。進行は、レヴィ小体( リン酸化されたα-シヌクレイン蛋白質の凝集 )の細胞内封入体(円形状の構造物)の蓄積が増える事により プロテアソームでの蛋白質分解が阻害されると共に進み、 パーキンソン病 ( Parkinson's disease:PD ) ↓ パーキンソン病に認知症が伴う ( Parkinson's with dementia:PDD ) ↓ パーキンソン病とレヴィ小体認知症 ( dementia with Lewy bodes:DLB ) と進行すると推測されています。 パーキンソン病の場合、レヴィ小体は黒質-緻密部のメラニン陽性細胞内、青斑核、迷走神経背側核、脊髄中間 質外側核、末梢交感神経節、内臓自律神経系にも高頻度に認められています。また、中枢神経系における自律 神経核や末梢自律神経系にレヴュ小体が出現。レヴィ小体認知症の場合、扁桃体、大脳辺縁系、大脳皮質に 多く出現が見られます。 若年性パーキンソン病は、患者全体の10%前後とされており10代でも発症事例があります。 原因は、遺伝子が大きく関わっており親族にも遺伝子異常があるケースがあります。進行は、とてもゆっくりで、薬の効果も長く続く事が特徴です。 家族性パーキンソン病は、患者全体の5-10%とされており、1個の遺伝子異常、複数の遺伝子異常が関わり 遺伝子の組み合わせなどが考えられています。 発症は優性と劣性に分けられ、優性の場合は、パーキンソン病の要因となる遺伝子を受け継いでいる可能性が 有り発症する確率が高くなる傾向があります。劣性の場合は親族が発症しても発症率は低いと言われています。 パーキンソン病の原因因子 ・孤発性パーキンソン病: α-シヌクレイン蛋白質( レヴィ小体 )によるプロテアソームでの分解阻害。 ・若年性パーキンソン病:遺伝子(parkinを含む)の変異により膜蛋白質のプロテアソームでの分解が阻害。主な症状は寡動で、 レヴィ小体は見られない。40歳以下でも発症するとされています。 ・家族性パーキンソン病: 遺伝子( α-synuclein. parkin. PINK1,ubiquitin,carboxyl-terminal. hydroPLAne-l )による。 パーキンが蛋白質分解に関わる「ユビキチンリガーゼ」の活性が無い事で分類できる。患者全体の5-10%が家族性パーキンソン病と言われています。 ・パーキンソン症候群:薬剤性、外傷性、脳血管障害、中毒(一酸化炭素)が原因因子と示唆されています。 パーキンソン病と認知症 パーキンソン病は、高率に認知症を合併する。認知症を発症するリスクは健常者の約5~6倍と考えられています。パーキンソン病患者の40%が、認知症を合併しているとの報告があり、8年間の追跡調査で、78%が認知症を発症との報告があります。 |
| 用語解説 レヴィ小体: 神経細胞内に形成される封入体で、円形、同心円状の芯を持つ。変性したα−シヌクレイン蛋白質が主成分。 副成分として複数の蛋白質を含みます。 α-シヌクレイン蛋白質: 神経終末に大量に存在する機能未知の蛋白質。レヴィ小体の主成分として知られています。 プロテアソーム : 蛋白質の分解を行う巨大な酵素複合体です。 細胞周期制御、免疫応答、シグナル伝達といった 細胞中の様々な働きに関わる機構です。 アミロイドβ蛋白質: 40アミノ酸程度のペプチド。アルツハイマー型認知症の病理学的特徴の一つである老人斑の主要構成成分はアミロイドβ蛋白質で、アミロイドβ蛋白質の蓄積はアルツハイマー型認知症発症の25年前から始まると報告されています。 タウ蛋白質: 中枢神経細胞に存在する微小管結合蛋白質の一つ。アルツハイマー型認知症の患者の脳には、老人斑と共に、異常にリン酸化されたタウ蛋白質の沈着物( 神経原線維変化 )が見られます。 アルツハイマー型認知症発症の15年前からタウ蛋白質の蓄積が始まるとの報告があります。 |
出現症状
出現症状 ( 運動症状・非運動症状と多岐にわたります )
| 運動症状 ( 錐体外路症状 )大脳基底核、神経伝達物質の異常によりの出現。手足のふるえ(振戦)、 手足のこわばり(筋固縮)、動作が緩慢(寡動、無動)、すくみ足(一歩が出ない)、転びやすくなる (姿勢反射障害)。片側の症状から始まり、両側の部分へ進行する特徴があります。 具体的には、安静時に片側の手や足がふるえる(安静時振戦)、表情が乏しく抑揚の無い小声 になる、関節が硬く引っ掛かりを持つ(歯車様固縮)、姿勢は前屈みになり、立ち姿も少し前屈みで歩き方 が小刻みである、歩く際に手を振らない、歩き始めや途中ですくむと次の一歩がなかなか出ない、歩き始めると 止まらない、身体がどちらかに傾く症状。 非運動症状 ( 統合失調症障害 ) 大脳辺縁系の神経伝達物質 異常によりの出現。 ・自律神経症状:便秘や立ちくらみ(起立性低血圧)、よだれが多くなる(流涎)、顔が脂ぎってくる、 トイレが近くなる、汗が多くなる、手足のむくみ、などの訴えが挙げられます。また、身体の痛みが起こる事も あります。 自律神経の中枢は視床下部で、交感神経、副交感神経のバランスが崩れた場合に起る症状。 視床下部、大脳辺縁系、大脳皮質のいずれかに強いストレスが加わると、自律神経のバランス(交感神経 ・副交感神経)を崩す可能性が出てくる事が知られています。 ・精神症状:睡眠障害、気持ちがふさぎこむ(抑うつ)、気持ちの落ち込み、意欲、自発性の低下、夜間の 不眠、 認知機能障害(記憶力や注意力の低下、物事を考えるとまとまらない)の症状。 ドーパミンは中脳 黒質から主とし被殻に投射する運動系のみならず、中脳の腹側被蓋野から側座核や前頭葉に投射する精神系でも神経伝達物質として放出されている。病状の進行とともに精神系のドーパミンが減少すると意欲の低下が目立つようになります。また、Lewy小体(レヴィしょうたい)が前脳基底部(basal forebrain)や大脳皮質に広がると、意識レベルの変動を伴う認知機能障害や幻視が出現し、Lewy小体型認知症(DLB:dementia with Lewy bodies)あるいは認知症を伴うパーキンソン病(PDD:Parkinson disease dementia)と呼ばれる状態になります。 案外記憶力は良いのだが、思考が遅くなり、自ら考えようとせず他人に依存的となる事が多い。 幻覚に対する周囲の対応が適切でないと妄想に発展して生活が混乱し、運動症状以上に日常生活を阻害することがあります。幻覚や妄想はLewy小体が広範に出現した場合のみならず、パーキンソン病の治療薬によって誘発されることもありますので注意が必要です。 一般的にドーパミン、セロトニン、ノルエピネフリンの増加により幻覚や妄想を誘発。あるいはアセチルコリンの減少は記憶の減衰を誘発。 |
病因と原因
病因・原因と病態 (脳内のドーパミンが不足)
| 病因:孤発性・家族性パーキンソン病で障害される中脳 黒質のドーパミン細胞内(軸索終末)にレヴィ小体(Lewy小体)と呼ばれる細胞内封入体が蓄積します。その主たる構成要素であるα-シヌクレイン(140アミノ酸からなるタンパク質)で、細胞内の神経伝達物質輸送に関係しています。 α-シヌクレインの構造が変化(リン酸化)して細胞膜を障害する事、ミトコンドリアに変化が起こる事、小胞体の機能障害を起こす事。細胞内のユビキチン・プロテオソーム系を障害して不要なタンパク質の分解を阻止する事など、パーキンソン病の病因としていくつかの仮説が提唱されています。 また、遺伝子異常により異常蛋白質が作られ事や、環境因子が影響することも明らかとなっています。 2003年 臨床病理的研究で発表された、Braak(ドイツの病理学者)のBraak仮説では、抗α-シヌクレイン抗体を用いて高齢者の中枢神経系におけるLewy小体の分布を詳細に検討し、Lewy小体は、まず嗅球に出現、迷走神経背側核(延髄)、視床と、その後、下部脳幹(橋)、中脳 黒質、扁桃体へ上行進展して運動症状を発現させる。 さらに前脳基底部(basal forebrain)、側頭葉皮質、大脳新皮質へと上行拡大して、精神症状など様々な非運動症状に関係すると考えられている。また、Zaccai博士の報告によると扁桃体に優位にLewy小体が分布しているとの報告もある。 Braak仮説: 嗅粘膜と腸管の上皮から病原体(neurotropic pathgen)が侵入して、Lewy小体を形成してパーキンソン病を起こす。病原体の侵入経路は、 1)嗅粘膜 → 前嗅神経核 → 中枢神経系へ。 2)腸管粘膜 → 粘膜下神経叢 → 副交感神経節前線維 → 迷走神経背側運動核へ。 パーキンソン病は、Lewy小体の出現に関連した神経変性疾患で、変性する神経細胞の部位は、 ・パーキンソン病:黒質、青斑核、迷走神経背側核、 マイネルト基底核。 ・Lewy小体認知症:大脳新皮質、辺縁系、扁桃核。 ・自律神経症: 末梢自律神経系。 現因:黒質の神経細胞の変性が起っている事によってドーパミンが十分な量が作られなくなると神経同士の連絡に不具合を生じる事でパーキンソン症状を起こすと考えられていましたが、最近では ”線条体でのド-パミン終末の減少” が原因と考えられています。 なぜ細胞が変性するかは解明されていませんが、遺伝子よる蛋白質異常、ミトコンドリアによる機能不全、酸化ストレス(活性酸素)、神経細胞内の蛋白質分解異常により神経変性すると言う研究発表もありますが原因不明です。 パーキンソン病患者の黒質細胞では、好酸性したLewy小体(蛋白質の固まり)を確認されており、異常蛋白質の細胞内蓄積を認める事から、Lewy小体を構成するアルファーシヌクレイン(α-synuclein)の過剰蓄積を認め、不要蛋白質の分解機能(ユビキチン・プロテアソーム)のUCH-L1(Ubiquitin carboxy-terminal hydrolase L1)と呼ばれる加水分解酵素の低下による細胞内分解機構の障害が、ドーパミン産生細胞脱落の原因として指摘されています。 アルファーシヌクレイン蓄積は、パーキンソン病をはじめとする神経変性疾患の原因とされ、ドーパミン量が20%を下回ると発病すると考えられており別の神経細胞とのバランスが崩れる事も症状の理由とされています。 また、マイネルト基底核によるアセチルコリン産生減少により記憶の減衰(記憶障害)にも影響するとの指摘もあります。 病理的所見では、神経細胞の脱落と伴に、神経細胞の中にα-シヌクレインの凝集(レヴィ小体)が形成される。中脳 黒質のほかに、動眼神経核、青斑核、迷走神経背側核などの脳幹の諸核に広汎に形成される。 大脳では、マイネルト基底核、視床下部、扁桃核の神経細胞内にも形成されやすい。 末梢神経系では、交感神経節、副交感神経節、腸管の神経叢、副腎にもレヴィ小体の出現が見られる。 細胞内だけでなく神経突起内にも形成、細胞外にも放出されるレヴィ小体が存在する。 パーキンソン病患者の黒質では、グルタチオン(アミノ酸からなるトリペプチド)・フェリチン(鉄分を貯蔵する蛋白質)が減少。また、黒質 → 線条体の神経細胞で、ミトコンドリア複合体の活動が減少しているとの報告もありますが、本質的に不明なままです。現在のところ、PDの神経変性過程には、細胞自律的機序と非細胞的機序の両者が複合的に関与すると考えられています。 細胞自律的機序としては、ミトコンドリアの生体エネルギー産生の変化、カルシウムのホメオスタシスの調節異常、ミトコンドリア代謝回転異常などが提唱されています。 非細胞的自立機序としては、ミスフォールド蛋白質のプリオン様挙動や神経炎症が挙げられ提唱されています。 パーキンソン病における細胞死は病原性イベントの多因子が段階的(カスケード)により引き起こされていると示唆されています。 パーキンソニズムとジストニアを中心とした神経症状の原因遺伝子は、ATP13A2とPLA2G6が関与。 ATP13A2蛋白質は、リソソーム内のpHの維持を行い、脂質代謝において脂質のリサイクルに関与している。 リソソームは細胞内の小器官、なかでもミトコンドリアに鉄を供給する役割をもっており、リソソームに 障害があるとミトコンドリアの鉄代謝に影響を及ぼすと考えられる。 他にも糖脂質を分解するライソゾーム酵素、グルコセレブロシターゼ(GBA)の欠乏によるゴ-シェ病(Gaucher)を発病し、パーキンソニズムを合併しやすく鉄の沈着もみられている。 PLA2G6蛋白質は、ミトコンドリア内膜のリン脂質(phospholipid)代謝に関与し、脂質二重膜の維持を行っていると考えられている。 GBA(遺伝子)の変異をともなうPD剖検脳のレヴィ小体においてGBAの免疫原性が報告され、変異型GBAは凝集能が高く、このことが原因でα-シヌクレインの凝集を促進し、神経変性を促進するという可能性が考えられている。 近年ゲノム解析により、GBAの遺伝子変異が弧発性シヌクレイノパチーの危険因子として作用することが確定された。GBAがアミノ酸変異により構造変化を起こして凝集しやすくなる結果、α-シヌクレインの凝集を誘発しレヴィ小体に至り神経変性に成ると考えられている。 神経細胞の変性、脱落、死を抑える成分としてビタミンE・C・βカロチンが有効と言われています。 |
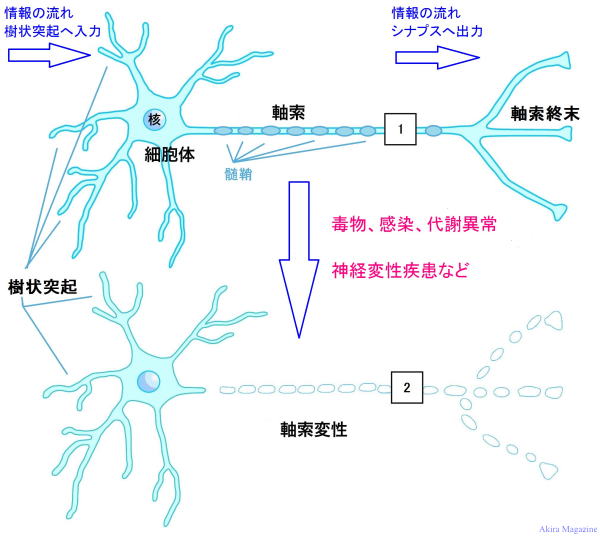 |
| 病態:パ-キンソン病は、黒質 緻密質のド-パミン分泌細胞の変性が主な原因です。 黒質 → 線条体の変性、脱落が 起こり脳内のド-パミン量(DA)低下が起こる。 また、前脳基底部のアセチルコリン産生量(Ach)も低下する。 (ドーパミンが減少する事で、アセチルコリン産生するコリナージック細胞の活動異常) ドーパミンを分泌する黒質は、運動神経系に重要な延髄、脊髄につながる大脳基底核にあります。 アセチルコリンを産生する前脳基底部は、記憶に重要な大脳皮質、海馬に繋がり放出しています。 大脳基底核の運動制御機構に基づいて、パーキンソン病の病態を説明すると、パーキンソン病とは、黒質 緻密部 のドーパミン細胞が変性・脱落することによって線条体のドーパミンが枯渇し、無動、固縮、振戦を主とする 運動障害が発症する疾患です。その際、 D1受容体を介する線条体の直接路細胞への興奮性入力が消失することにより、これらの細胞の活動性が減弱し、その結果、淡蒼球 内節の神経活動は亢進します。他方、 D2受容体を介する線条体の間接路細胞への抑制性入力が消失することにより、これらの細胞の活動性が 亢進し、その結果、淡蒼球 外節の神経活動の減弱と、それに続く視床下核の神経活動の亢進が起こり、淡蒼球 内節の神経活動は亢進します。 この様に、パーキンソン病における線条体でのドーパミンの枯渇は、直接路と間接路のいずれにおいても、淡蒼球 内節(黒質 網様部でも同様)の神経活動を上昇させる方向に作用し、最終的に視床および大脳皮質の活動性を抑制することになります。(神経伝達物質ループ、バランス異常項目を参照)。つまり、 パーキンソン病では、淡蒼球 内節や黒質 網様部における神経活動の亢進によって、視床および大脳皮質に 対する脱抑制が不十分になるため、運動を円滑に発現できなくなり、無動症状を呈すると解釈できます。 前脳基底部の機構に基づきパーキンソン病の記憶の減衰、認知機能の障害を説明すると、アセチルコリン起始核である前脳基底部の 中隔核 → 視床・帯状回 → 海馬。マイネルト基底核 → 大脳皮質で。アセチルコリンが減少する事で、認知機能・記憶障害が発症。 また、パーキンソン病患者では、腸管におけるアウエルバッハ神経叢の変性も初期から認められている。 アウエルバッハ神経叢とは: 腸管神経の一部、消化管の縦走筋層と輪走筋層との間に位置し、このふたつの筋層に運動刺激を粘膜に分泌刺激。 アウエルバッハ神経叢は交感神経線維と副交感神経線維の両方を有する。 この神経叢は延髄の迷走神経三角から伸びており、この神経叢は食道、胃、小腸と大腸の筋肉内にみられる。 パーキンソン病の障害脳部位図 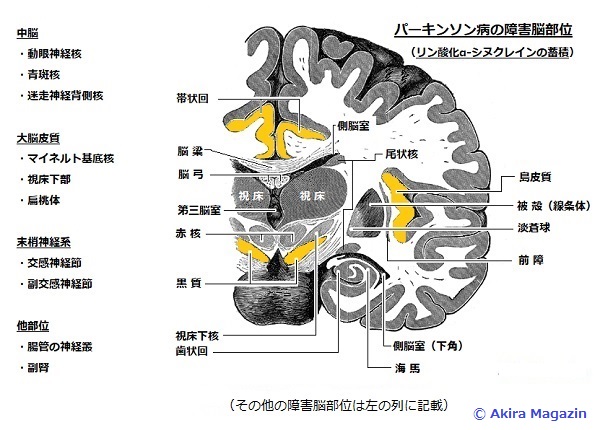 |
神経伝達物質ループのバランス異常
神経伝達物質ループのバランス異常
| 大脳基底核は小脳とともに、随意運動の発現と制御に重要な役割を担う高次中枢として知られています。 大脳基底核は大別すると、線条体、淡蒼球、黒質、視床下核の4つの神経核から成り、さらに、線条体(せんじょうたい)は尾状核(びじょうかく)と被穀(ひかく)に、淡蒼球(たんそうきゅう)は外節と内節、黒質は緻密部(ちみつぶ)と網様部(もうようぶ)に分類されます。 大脳基底核には、大脳皮質の広い領域から、運動に直接関与した情報だけでなく、感覚や情動、あるいは認知機能に関する情報など、運動発現に影響を与えるさまざまな情報が入力されます。これらの情報は大脳基底核で統合・処理されたのち、運動内容を決定する信号として、最終的には前頭葉の運動野から脊髄に出力されますが、その際、大脳基底核は、大脳皮質、特に運動野や前頭前野が分布する前頭葉との間でループ回路が形成されています。 つまり、前頭葉から出力された運動情報や認知情報は、大脳基底核を巡り、その大部分が視床(ししょう)を介して再び前頭葉に戻るようなループ回路の中を伝達されるわけです。 直接路と間接路 神経回路には、入力部である線条体と出力部である淡蒼球内節や黒質網様部の間を直接つなぐ「直接路」と、介在部である淡蒼球外節と視床下核を経由して両者を間接的につなぐ「間接路」の2つが存在すると考えられています。 直接路と間接路を形成する線条体の細胞はGABA(用語集参照)を有する抑制性であり、大脳基底核の修復部である黒質緻密部からドーパミン入力を受け、それぞれ興奮もしくは抑制の相反する神経活動を示します。つまり、 直接路を形成する細胞にはD1受容体を介してドーパミン入力が興奮性に作用するに対して、 間接路を形成する細胞にはD2受容体を介してドーパミン入力が抑制性に作用します。 |
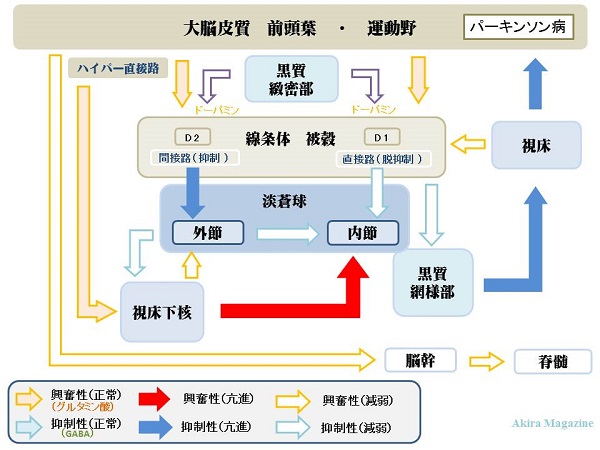 |
| また、淡蒼球内節と黒質-網様部もGABAを有する抑制性の細胞で構成されており、常に活発に活動しているため、そのターゲットである視床の神経活動を持続的に抑制しています。 前頭葉からの入力により線条体の細胞が興奮すると、直接路を介して淡蒼球内節や黒質網様部の神経活動が抑制され、一時的に視床に対する抑制が取り除かれる「脱抑制」と言う現象が起こります。これにより視床および前頭葉の活動が亢進(こうしん)し、結果的に必要な運動が惹起(じゃっき)されると考えられます。 他方、間接路については、淡蒼球外節から視床下核への神経連絡がGABAによる抑制性で、視床下核から淡蒼球内節や黒質網様部への神経連絡がグルタミン酸による興奮性であるため、視床および前頭葉にたいして直接路とは逆の効果をもたらすと事に成ります。 視床下核から淡蒼球への連絡と線条体から淡蒼球への連絡を細胞レベルで比較すると、前者が淡蒼球の比較的広い領域をカバーするのに対し、後者は狭い領域に限局する事が知られています。 直接路が狭い領域への脱抑制効果をおして特定の運動発現に寄与するのに対し、間接路は、その周辺領域への抑制効果により、それ以外の不必要な運動の抑止に貢献していると考えられています。 |
パーキンソン病の検査
パーキンソン病の検査
| PD・認知症の検査種類 医師の問診の結果により検査が行われますが、近年、PD検査が進歩しました。検査の種類を紹介します。 ・PD除外検査 血液検査、尿検査、MRI、CTスキャーン、内分泌検査で異常が無い事を確認。 (癌、脳腫瘍、糖尿病、他の疾患が無い事を確認) ・UPDRSスケール パーキンソン病を総合的に評価する基準として、世界中の研究者や医師に広く良く用いられています。 ヤール重症度分類に比べてはるかに細かく評価することができます。 ・MIBG心筋シンチグラフィー検査 MIBGの集積が心筋に高度に低下している場合、心臓の交感神経機能の低下が疑われ、PD、レヴィ小体認知症の所見となる。 ・画像スペクト検査(SPECT:single photon emission CT) CTでは表わせなかった脳の血流量や代謝機能の情報が得られる。 ・DAT-scan検査 脳部位の線条体 → 黒質のドーパミントランスポータ(DAT)の密度が低下していかどうかが分かる。 (PD、レヴィ小体認知症では、DATの密度が低下している)認知機能疾患の検査。 パーキンソン病患者にL-dopaを150mg、300mg、600mg/日に分け1年間の観察期間後、臨床症状と、 脳機能画像を比較検討結果では600mg/日のみで、線条体における有意なI-β CIT剤結合の低下が示唆。 ・PET検査(陽電子放射断層撮影) SPECTよりもなおいっそう代謝などの様子を正確に把握でき、脳の内部のブドウ糖やアミノ酸の代謝、酸素の消費量の変化を調べて、脳機能の障害部位を診ることができます。 また、脳疾患の病態解明や微小な腫瘍の発見には現在最も有効とされています。さらに、神経伝達物質とその 受容体(レセプター)を測定することで、精神病の病態の解明にも役立つ。 (日本においては2015年3月現在、保険適応外) 記憶障害検査 ・長谷川式認知症スケール(HDS-R):PDの場合、比較的高い点数をしめす。 ・ウェクスラー式知能検査:詳細な検査を行うと認知機能障害が明らかになる。 |
進行を遅らせられるか
進行を遅らせられる治療は?食べ物は?( 初期・中期・終末期の主な出現症状 )
| 現在用いられている治療・療法では、ADL(日常生活動作)の低下、QOL(快適な生活環境)の改善ができますが、パーキンソン病の主たる原因であるドーパミン神経の変性に対しては遅らせられる治療は有りません。 治療開始時期に改善した症状も、その後、神経変性の進行に伴い強く成っていきます。 神経の変性を抑制し症状を悪化させない治療、薬は現在、確認されていません。 食べ物(異常蛋白質の凝集阻害)。 レヴィ小体(Lewy小体)は、神経変性疾患(パーキンソン病、Lewy小体認知症)の原因と示唆されており、アルファーシヌクレイン蛋白質の凝集によりLewy小体が出来ることが知られています。 Lewy小体の原因であるα-シヌクレインの凝集を阻害する物質には、クミンアルデヒド(Cuminaldehyde)が有効とされています。ユーカリ、ミルラ、カシア、クミンなどに含まれています。また、 納豆、パセリ、豆腐、緑茶、ピーマン、パパイヤなどに含まれる酸化還元補酵素のピロロキノリンキノン(Pyrroloquinoline quinone、PQQ)ビタミンB群も α-シヌクレインの凝集や蓄積が抑えられるとの研究発表があります。また、 アルツハイマー病に中鎖脂肪酸を摂取する事で症状が改善されたとの報告があります。 中鎖脂肪酸は、ココナッツ、パームフルーツ、牛乳、パーム油、ヤシ油(ココナッツオイル)などにも多く含まれ ています。 中鎖脂肪酸100%の油は、手術後の流動食や未熟児のエネルギー補給などに長年利用されています。 食物の紹介は、” 栄養と食材 ” ページに紹介しています。 孤発性パーキンソン病の進行・初期・中期・末期の主な出現症状。 レヴィ小体(リン酸化されたα-シヌクレイン蛋白質の凝集 )の細胞内封入体の蓄積が増えると共に進み、運動、非運動機能の障害が増大。 パーキンソン病 (Parkinson's disease:PD) ↓ パーキンソン病に認知症が伴う (Parkinson's with dementia:PDD ) ↓ パーキンソン病とレヴィ小体認知症 (dementia with Lewy bodes:DLB ) と進行すると示唆されています。 初期の症状: ・手足の関節が動かしにくい。 ・安静時に振戦(ふるえ)、手・足の片側より起りやがて両方に。 ・歩行障害、歩き出す時に初めの1歩が踏み出せなくなる。歩幅は狭い。方向転換が出来にくい。 ・動作緩慢(筋固縮による)、日常生活の動作が遅くなり、衣類の着脱・食事・寝がえりなど、 すべての動作に支障をきたす。 中期の症状: ・姿勢異常、前屈みになり、手足の指が反れる事もある。 ・幻覚(幻視・幻聴)、うつ症状、記憶力の低下、不眠(薬の副作用の場合がある) ・嚥下障害・構音・流涎、食べ物を飲み込みにくい、ろれつが回らない、滑舌が悪い、よだれが出る。 (薬の副作用の場合がある) ・顔の表情が固くなる、瞼が自然に下がってくる。 末期の症状: ・言語障害、声が小さくなる、早口になる。 ・認知症、記憶力、注意力の低下、考えがまとまらない。健常者に比べ認知症になるリスクは5~6倍。 ・寝たっきりで、移動は車椅子。 注)パーキンソン病患者により出現症状、進行は異なりますので目安として記載しました。 |











